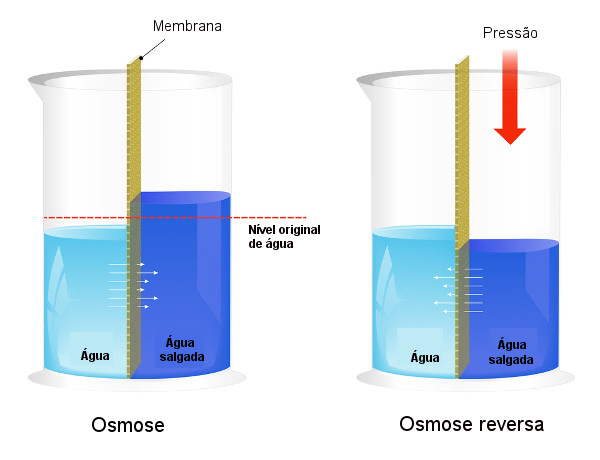
A osmose é um transporte de solvente através de uma membrana semipermeável em que o solvente de uma solução menos concentrada flui para uma solução mais concentrada. A membrana semipermeável atua de forma seletiva, permitindo apenas a passagem de certos tipos de moléculas ou íons. O fluxo de solvente irá ocorrer até que a solução receptora atinja a pressão osmótica necessária, fazendo com que o sistema entre em equilíbrio.
A osmose é essencial para a nossa vida, uma vez que auxilia na troca de nutrientes das nossas células. A osmose reversa, uma outra aplicação baseada na osmose, aplica pressão de modo a inverter o fluxo de solvente, o que é muito útil na dessalinização da água do mar, por exemplo. A osmometria é também uma técnica importante nos laboratórios, pois auxilia na determinação de massas molares de substâncias.
Leia também: Propriedades coligativas — tonoscopia, ebulioscopia, crioscopia e osmose
Tópicos deste artigo
- 1 - Resumo sobre osmose
- 2 - Videoaula sobre osmose
- 3 - O que é osmose?
- 4 - Como funciona a osmose?
- 5 - Tipos de osmose
- 6 - Exemplos de osmose
- 7 - Exercícios resolvidos sobre osmose
Resumo sobre osmose
- A osmose é um transporte de solvente através de uma membrana semipermeável.
- Durante a osmose, há um fluxo de solvente da solução menos concentrada para uma solução mais concentrada.
- A membrana semipermeável atua de forma seletiva, permitindo a passagem de solvente e alguns outros componentes, apenas.
- O fluxo de solvente é cessado quando o sistema atinge o equilíbrio, marcado pelo momento em que a solução receptora de solvente atinge a pressão osmótica.
- A osmose tem grande importância para o funcionamento de nossas células, além de ser utilizada para dessalinização da água do mar (osmose reversa) e na determinação da massa molar de moléculas (osmometria).
Videoaula sobre osmose
O que é osmose?
A osmose é entendida como o transporte de solvente através de uma membrana para uma solução mais concentrada. É possível reproduzir a osmose em laboratório pela adoção de uma membrana semipermeável, a qual só permite a passagem de certos tipos de moléculas ou íons.
Como funciona a osmose?
Na osmose, temos o fluxo do solvente, por meio de uma membrana semipermeável, para uma solução. A figura a seguir é importante para ilustrarmos e entendermos o processo básico da osmose.
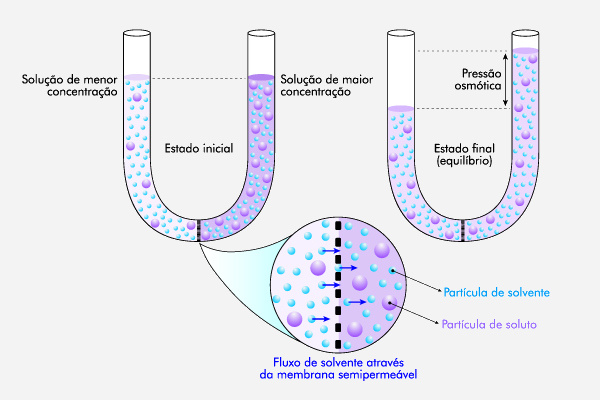
Inicialmente, a solução menos concentrada e a solução mais concentrada, separadas por uma membrana semipermeável, estão com a mesma altura. Contudo, com o passar do tempo, o solvente da solução menos concentrada começa a fluir para a solução mais concentrada, criando-se um desnivelamento.
O desnivelamento cessa quando o sistema atinge um estado de equilíbrio dinâmico, em que a pressão exercida pela coluna da solução é suficientemente grande para que haja igualdade no fluxo de moléculas através da membrana, em ambas as direções. Dessa forma, pode-se entender que o fluxo líquido total é zero. Essa pressão necessária para deter o fluxo do solvente é conhecida como pressão osmótica, sendo representada pela letra grega maiúscula pi, Π.
Quando o sistema atinge equilíbrio por conta da igualdade de fluxo por meio da membrana (fluxo líquido zero), dizemos que as soluções são isotônicas, ou seja, possuem a mesma pressão osmótica.
A causa da osmose pode ser entendida termodinamicamente. Uma solução mais concentrada possui uma maior entropia (maior grau de desordem) e, consequentemente, uma menor energia livre de Gibbs (vale lembrar que ΔG = ΔH – T∙ΔS). Já a solução menos concentrada, com a menor presença de soluto, apresenta uma menor entropia e, por conseguinte, uma maior energia livre de Gibbs. Dessa forma, o solvente flui em direção à solução mais concentrada de modo que se atinja igualdade das energias livres de Gibbs (estado de equilíbrio).
Leia também: Como calcular a pressão osmótica
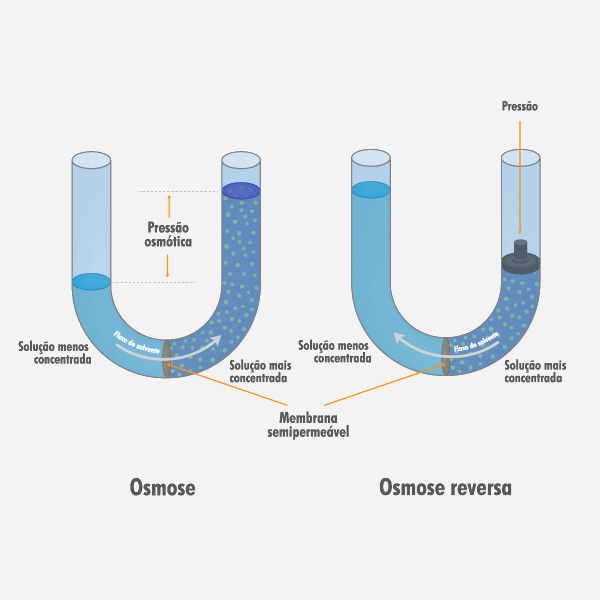
Tipos de osmose
Além da osmose convencional, explicada anteriormente, duas outras formas de se pensar a osmose podem ser destacadas.
-
Osmometria
É uma técnica que se utiliza da pressão osmótica para determinar a massa molar do soluto, por meio da equação de van’t Hoff.
Π = iRTM
Onde “i” é o fator de van’t Hoff, “R” é a constante dos gases ideais, “T” é a temperatura (em Kelvin) e “M” é a concentração em quantidade de matéria (concentração molar, mol/L).
-
Osmose reversa
É uma técnica em que se aplica uma pressão maior do que a pressão osmótica na solução mais concentrada, de modo que haja inversão do fluxo de solvente, forçando as moléculas do solvente a fluírem da solução mais concentrada para a solução menos concentrada.
Exemplos de osmose
-
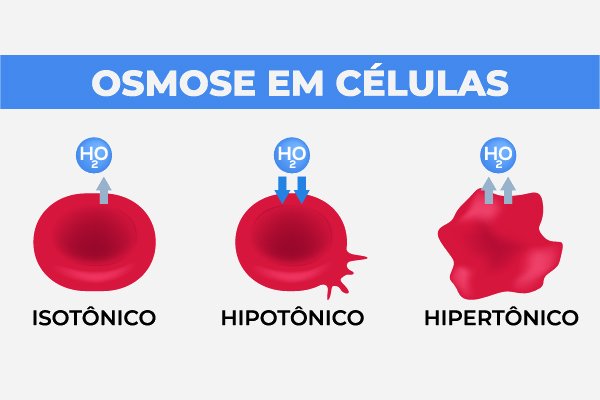
Osmose em células
As paredes celulares atuam como membranas semipermeáveis, que permitem a passagem de água, de moléculas pequenas e de íons hidratados. Contudo, bloqueiam a passagem de enzimas e proteínas que são produzidos dentro da estrutura celular.
As diferenças de concentração no meio intracelular e no meio extracelular fazem surgir uma pressão osmótica, de modo que o meio intracelular pode apresentar maior pressão osmótica que o meio extracelular — hipertônico —, onde a água flui, portanto, para o meio externo, deixando a célula desidratada (murchidão).
De maneira contrária, a pressão osmótica do meio intracelular pode ser menor que a pressão osmótica do meio extracelular — hipotônico — e, dessa forma, a água é transportada para o interior da célula, levando moléculas pequenas de nutrientes. Por consequência, a célula apresenta turgidez (inchaço).
-
Osmose em alimentos
Saladas se tornam murchas depois de um tempo por conta da osmose. Nesse caso, o meio que contém temperos (como sal, pimenta, vinagre, etc.) pode ser entendido como uma solução de maior concentração. Dessa forma, a água flui de dentro das células vegetais para o meio externo, causando a desidratação dos vegetais.
Salgar carnes foi, por muito tempo, o principal método de conservação desse alimento. No caso, o excesso de sal faz com que as bactérias sofram desidratação via osmose, sendo então destruídas.

-
Dessalinização da água
A osmose reversa pode ser utilizada para a remoção de sais da água do mar e, assim, criar água potável e para irrigação. É muito útil para locais que não possuem grandes reservas de água doce. O problema, contudo, é desenvolver membranas que suportem as altas pressões do processo, sem contar no custo operacional e na quantidade de sal residual, a qual necessita de descarte adequado e consciente.
-
Determinação da massa molar
A osmometria é muito aplicada em laboratórios para a determinação das massas molares de polímeros e outras macromoléculas. Vejamos no caso em que 2,20 gramas de polietileno são dissolvidos em 100 mL de benzeno, gerando uma pressão osmótica de 1,10 ∙ 10−2 atm a 25 °C.
Nesse caso, explicita-se M (concentração molar) da equação de van’t Hoff, no qual o fator de van’t Hoff (i) é igual a 1, pois o soluto é molecular, não causando o aumento do número de mols de partículas na solução:
M = Π / iRT
M = 1,10 ∙ 10−2 atm / 1 ∙ 0,0821 atm∙L∙K−1∙mol−1 ∙ 298 K
M = 4,5 ∙ 10−4 mol∙L−1
O número de mols pode ser calculado mediante a multiplicação da concentração molar pelo volume:
n = M ∙ V
n = 4,5 ∙ 10−4 mol∙L−1 ∙ 0,1 L
n = 4,5 ∙ 10−5 mol
Como a massa molar (MM) é calculada pela divisão da massa do soluto pelo seu número de mols, temos que a massa molar calculada para o polietileno é:
MM = m/n
MM = 2,20 g/4,5 ∙ 10−5 mol
MM = 4,89 ∙ 104 g∙mol−1
Leia também: Osmose na célula vegetal e animal
Exercícios resolvidos sobre osmose
Questão 1
(Udesc – Inverno – Tarde/2024.2) Assinale a alternativa que corresponde ao volume em mL de solução de glicose 2,00 mol/L, que deve ser utilizada para preparar 1,00 L de solução de glicose, que tenha pressão osmótica igual a 7,7 atm a 37 ºC.
A) 35,0
B) 25,0
C) 750
D) 1,50
E) 150
Resposta: Letra E.
A solução de 1 L de glicose, utilizada no experimento, é obtida a partir da diluição da solução 2 mol/L. A diluição é calculada da seguinte forma:
Mi ∙ Vi = Mf ∙ Vf
A concentração molar inicial (Mi) é de 2 mol/L, e o volume final (Vf) é de 1 litro. Resta saber o volume inicial (Vi), enquanto a concentração final (Mf) será obtida pela equação de van’t Hoff.
Pela equação de van’t Hoff, temos que:
Π = iRTM
Dessa forma, substituindo-se os valores, podemos encontrar a concentração molar da solução de glicose, M, que possua volume de 1 litro. Sendo um soluto molecular, o fator de van’t Hoff (i) para a referida solução é igual a 1.
Substituindo-se os valores, temos que:
7,7 = 1 ∙ 0,082 ∙ 300 ∙ M
M = 7,7/24,6
M \(\cong\) 0,3 mol/L
Substituindo na expressão da diluição, temos que:
Mi ∙ Vi = Mf ∙ Vf
2 mol/L ∙ Vi = 0,3 mol/L ∙ 1000 mL
Vi = 300/2
Vi = 150 mL
Questão 2
(Unifor 2024.1) A prática de adicionar sal aos alimentos para conservação tem raízes antigas e remonta a séculos. A conservação de alimentos por meio do sal, conhecida como salga, é uma técnica tradicional que era utilizada muito antes do desenvolvimento de métodos modernos de conservação, como refrigeração, congelamento e enlatamento.
Em relação à adição de sal como agente conservante de alimentos, podemos afirmar que se trata de um processo físico-químico que envolve
A) liofilização.
B) crioscopia.
C) osmose.
D) esterilização.
E) filtração.
Resposta: Letra C.
A adição de sal cria um gradiente de concentração entre a carne e o meio externo. Dessa forma, a carne salgada é um meio mais concentrado que, por osmose, recebe o fluxo de água das bactérias, desidratando-as e destruindo-as, assim mantendo a carne conservada.
Fontes
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.