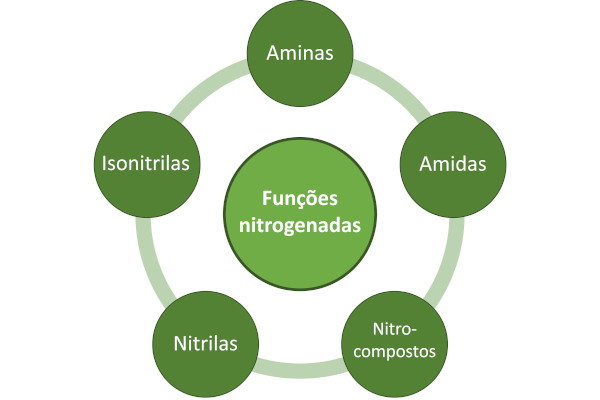
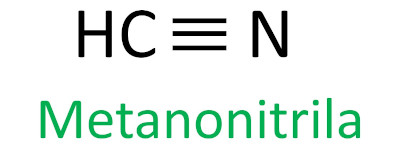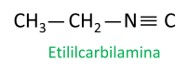As funções nitrogenadas são um grupo de compostos orgânicos que possuem átomos de nitrogênio unidos à cadeia carbônica. Diferenciam-se pelos respectivos grupos funcionais, que são conjuntos de átomos ligados em determinada configuração e que definem as propriedades características de cada função.
As funções nitrogenadas são:
-
Não pare agora... Tem mais depois da publicidade ;)
Leia também: Quais são as funções oxigenadas?
Tópicos deste artigo
- 1 - Resumo sobre as funções nitrogenadas
- 2 - Videoaula sobre as funções nitrogenadas
- 3 - O que são as funções nitrogenadas?
- 4 - Quais são as funções nitrogenadas?
- 5 - Aplicações das funções nitrogenadas
- 6 - Exercícios resolvidos sobre funções nitrogenadas
Resumo sobre as funções nitrogenadas
-
As funções nitrogenadas são compostos orgânicos que contêm átomos de nitrogênio.
-
Aminas, amidas, nitrocompostos, nitrilas e isonitrilas são as funções nitrogenadas.
-
As funções inorgânicas se diferenciam pelo seu grupo funcional.
-
As aminas são derivadas da substituição dos hidrogênios da amônia por radicais alquila.
-
As amidas possuem um mesmo átomo de carbono unido ao nitrogênio e ao oxigênio.
Não pare agora... Tem mais depois da publicidade ;) -
Os nitrocompostos contêm o grupo -NO2.
-
As nitrilas se caracterizam pela presença de ligação tripla entre carbono e nitrogênio.
-
As isonitrilas possuem ligação tripla entre nitrogênio e carbono, sendo o nitrogênio unido à cadeia carbônica.
Videoaula sobre as funções nitrogenadas
O que são as funções nitrogenadas?
As funções nitrogenadas são um conjunto de funções orgânicas que possuem o átomo de nitrogênio em sua estrutura, além dos átomos de carbono e de hidrogênio. São elas: aminas, amidas, nitrocompostos, nitrilas e isonitrilas,
O que diferencia as funções nitrogenadas são os respectivos grupos funcionais, que são o arranjo estrutural de átomos responsável pelas propriedades da substância.
Quais são as funções nitrogenadas?
-
-
Aminas
-
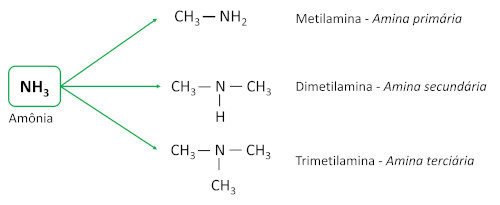
A função orgânica amina é caracterizada pela ligação de ao menos uma cadeia carbônica ao átomo de nitrogênio. O grupo funcional das aminas é -N-R1R2R3 (os grupos R são cadeias carbônicas ou átomos de hidrogênio, sendo pelo menos um deles cadeia carbônica).

As aminas são derivadas da amônia (NH3), com um ou mais átomos de hidrogênio substituídos por átomos de carbono ou ligantes alquila. São substâncias básicas, deixando o pH superior a 7 em solução aquosa.
Elas são classificadas de acordo com a quantidade de átomos de hidrogênio substituídos por ligantes de carbono (grupos alquila ou arila), que são chamados de substituintes.
- Aminas primárias: possuem um único substituinte carbônico.
- Aminas secundárias: possuem dois substituintes carbônicos.
- Aminas terciárias: possuem três substituintes carbônicos, ou seja, o átomo de nitrogênio não está mais ligado a nenhum átomo de hidrogênio, estabelecendo três ligações simples com átomos de carbono.
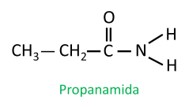
A nomenclatura para as aminas segue as orientações da Iupac (União Internacional de Química Pura e Aplicada). No caso das aminas primárias, a construção do nome se dá considerando o número de carbonos (prefixo), a natureza da ligação entre carbonos (infixo) e usa-se o termo amina para o sufixo (final da palavra).

Veja o exemplo:
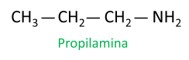
Ao atribuir números aos carbonos para a localização de radicais, atribui-se o menor número possível ao átomo mais próximo do grupo NH2.
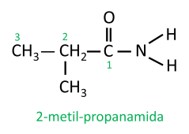
Para aminas secundárias e terciárias, a nomenclatura considera o grupo substituinte mais longo ligado ao nitrogênio como a cadeia principal, e os demais ligantes são escritos com o prefixo referente ao número de carbonos e o sufixo -il, com a indicação da letra N antes deles.

Exemplo:
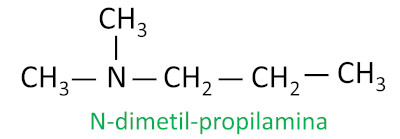
-
-
Amidas
-
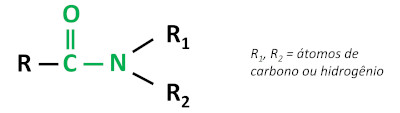
A função orgânica amida se caracteriza pela ligação de um grupo carbonila (C=O) ao átomo de nitrogênio, sendo que o nitrogênio pode estar ligado a átomos de carbono ou hidrogênio.
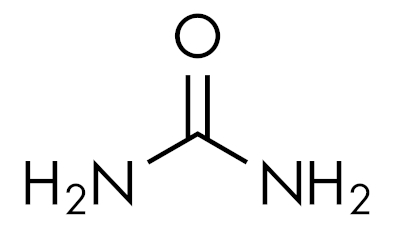
As amidas são substâncias básicas, deixando o pH acima de 7 em solução aquosa. A substância ureia pertence ao grupo das amidas e é um composto naturalmente presente na urina, derivado de processos de degradação que ocorrem nos organismos vivos.
As amidas são características em função do nível de substituição do nitrogênio. Assim:
- Amidas primárias: mantêm dois átomos de hidrogênio unidos ao nitrogênio.
- Amidas secundárias ou monossubstituídas: um dos hidrogênios foi substituído por cadeia carbônica, de modo que o nitrogênio mantém uma única ligação com hidrogênio.
- Amidas terciárias ou dissubstituídas: o nitrogênio não possui mais ligações com hidrogênio, sendo que todas elas foram substituídas por carbonos.
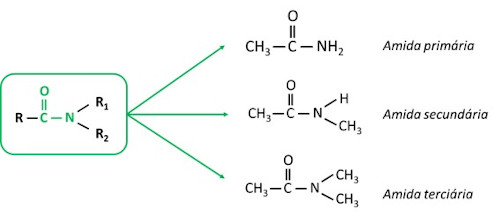
As amidas são nomeadas de acordo com a Iupac, sendo as moléculas denominadas pela sequência:

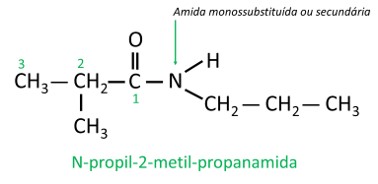
Em amida ramificada, o átomo de carbono do grupo amida participa da cadeia principal, e a contagem dos carbonos deve ser iniciada por ele. Veja:
|
|
|
Em amidas monossubstituídas ou dissubstituídas, a letra N indica a posição da ramificação que está ligada ao átomo de nitrogênio. Se houver outro radical na cadeia, ele será escrito após a identificação do radical referente ao N.
-
-
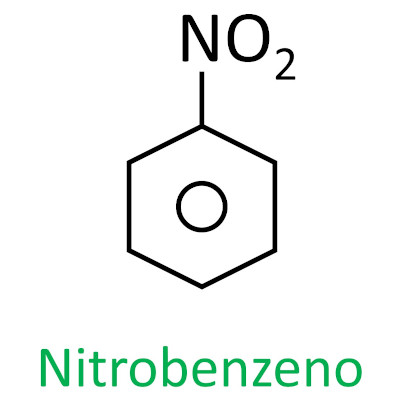
Nitrocompostos
-
Os nitrocompostos são compostos orgânicos que possuem o grupo nitro (-NO2) unido a uma cadeia carbônica, que pode ser alifática (aberta ou linear) ou aromática.
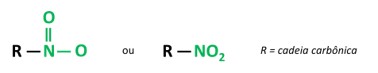
A principal característica dessas substâncias é seu poder explosivo. A capacidade de explosão está associada aos nitrocompostos aromáticos, e quanto maior o número de grupos nitro, maior será a explosão. Os nitrocompostos alifáticos são usados em laboratórios como solventes orgânicos.
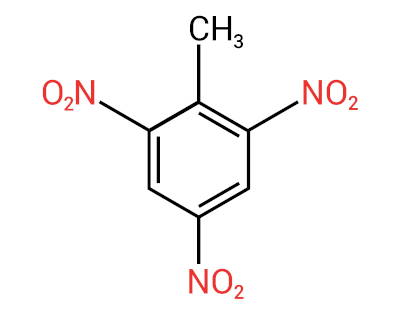
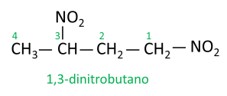
A nomenclatura para esses compostos é formada pela palavra nitro seguida do nome do hidrocarboneto (prefixo + infixo + terminação -o).
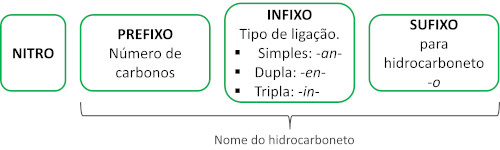
Veja alguns exemplos:
|
|
|
-
Nitrilas
As nitrilas são compostos orgânicos caracterizados pela ligação tripla entre um átomo de carbono e um átomo de nitrogênio, apresentando o grupo funcional – C ≡ N. Nas nitrilas, o nitrogênio está na extremidade e o carbono está ligado diretamente à cadeia carbônica.
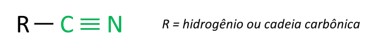
As nitrilas também são conhecidas como cianetos, pois derivam de reações com o ácido cianídrico (HCN).
Elas são substâncias tóxicas aos seres humanos, pois dentro do organismo podem formar ácido cianídrico em contato com o ácido do estômago, impedindo processos de respiração celular das células.
Na natureza, as nitrilas podem ser encontradas em algumas frutas de caroço, mas em uma concentração muito baixa, não apresentando riscos, e nas folhas da mandioca-brava.

A regra Iupac para a nomenclatura das nitrilas define que o termo nitrila seja adicionado como sufixo:

Veja alguns exemplos:
|
|
|
A forma usual de nomenclatura para as nitrilas é cianeto + nome do radical.
-
-
Isonitrilas
-
As isonitrilas, ou isonitrilos, são compostos formados pela ligação tripla entre um átomo de carbono e um átomo de nitrogênio, apresentando o grupo funcional – R ≡ C. Nas isonitrilas, o carbono está na extremidade e o nitrogênio está ligado diretamente à cadeia carbônica.

As isonitrilas se diferenciam das nitrilas em razão da posição dos átomos de nitrogênio e carbono, sendo que nas isonitrilas o nitrogênio é caracterizado como um heteroátomo, pois está posicionado entre dois carbonos.
Elas são espécies instáveis e podem se converter em nitrilas em elevadas temperaturas. As reações do ácido isocianídrico dão origem às isonitrilas, por isso esses compostos também são conhecidos como isocianetos.
As moléculas de isonitrilas seguem a regra Iupac para nomenclatura:
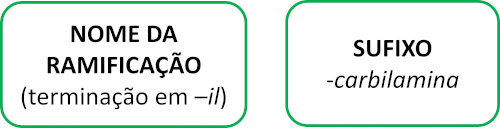
Veja alguns exemplos:
|
|
|
Aplicações das funções nitrogenadas
As substâncias pertencentes às funções nitrogenadas possuem inúmeras aplicações, principalmente na área industrial, para fabricação de polímeros, borrachas, fibras sintéticas, fármacos, agrotóxicos, pesticidas e explosivos.
As aminas são usadas na produção de corantes, sabões, fármacos, no processo de vulcanização da borracha, explosivos e outros processos industriais, sendo também encontradas em vegetais e formadas em processos de decomposição de matéria orgânica.

As amidas têm ampla aplicação no setor industrial e químico, estando presentes na produção de polímeros (como o náilon e o poliuretano), resinas, explosivos, fertilizantes, repelentes de insetos, adubos e fármacos.

Os nitrocompostos têm como principal aplicação a fabricação de explosivos que são usados no setor militar, industrial e metalúrgico (para extração de matéria prima). Um dos nitrocompostos mais conhecidos é o trinitrotolueno, popularmente conhecido como TNT. Outras aplicações dos nitrocompostos são na produção de agrotóxicos, bactericidas, corantes, refino de petróleo etc.

As nitrilas são usadas como solventes orgânicos em laboratório e na indústria, participando de processos de extração e de fabricação de algumas fibras sintéticas, polímeros plásticos, corantes e fertilizantes.

As isonitrilas são empregadas em vários processos de produção de compostos orgânicos, como solventes, e participam da fabricação de agrotóxicos, pesticidas, borrachas e plásticos.
Leia também: Haletos — substâncias que possuem átomos de halogênios ligados à cadeia carbônica
Exercícios resolvidos sobre funções nitrogenadas
Questão 1
(FPS-PE-modificada) A aplicação de compostos nitrogenados em Química Orgânica sintética é muito diversificada e envolve a preparação de medicamentos, corantes, explosivos e vitaminas. Observe os compostos abaixo.
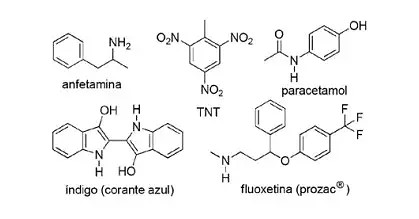
Sobre esses compostos, assinale a afirmativa incorreta.
a) O TNT é um nitrocomposto.
b) A porção nitrogenada da fluoxetina é uma amina secundária.
c) A anfetamina é classificada como amida primária.
d) O índigo possui anéis heteroaromáticos em sua estrutura.
e) A porção nitrogenada do paracetamol é uma amida.
Resolução:
Letra C
O item a está correto, pois o TNT é um composto nitro porque apresenta grupos NO2.
O item b está correto. A porção nitrogenada da fluoxetina é uma amina secundária, porque está ligada a dois segmentos carbônicos.
O item c está incorreto, pois a anfetamina é classificada como amina primária, e não amida. Note que o grupo presente é NH2. Logo, esse é o gabarito da questão.
O item d está correto, pois o índigo possui anéis heteroaromáticos em sua estrutura, ou seja, anéis formados por átomos de carbono e outro elemento — nesse caso, o nitrogênio.
O item e está correto, porque o paracetamol é uma amida, apresentando carbono ligado ao nitrogênio e ao oxigênio.
Questão 2
(UFMS) A erva mate (Ilex paraguariensis), originária da América do Sul, é utilizada como bebida tônica e estimulante. O produto obtido por meio do beneficiamento das folhas da erva mate pode ser utilizado para o preparo de chimarrão e tereré, entre outras bebidas de consumo habitual e cultural em regiões da Argentina, Paraguai e Brasil. O grande interesse na erva mate deve-se aos compostos químicos presentes, em função de suas propriedades antioxidante, estimulante e diurética.
(Disponível em: http://repositorio.utfpr.edu.br/jspui/bitstream/1/3158/1/PG_PPGEP_Henrique%2C%20 Flavia%20Aparecida_2018.pdf. Acesso em: 01 nov. 2018. Adaptado).
As propriedades estimulantes da erva mate estão relacionadas aos seus teores de metilxantinas, sendo uma das principais a cafeína, estrutura apresentada a seguir:
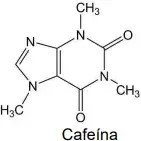
Ao analisar a fórmula estrutural da cafeína, é correto afirmar que ela possui as funções orgânicas e propriedades:
a) aldeído e amida, básicas.
b) amina e amida, alcalinas.
c) amina e cetona, alcalinas.
d) cetona e amida, anfóteras.
e) ácido carboxílico e amina, básicas.
Resolução:
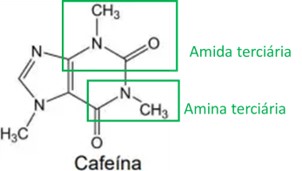
Letra B
Analisando a estrutura da cafeína, são identificados os grupos funcionais amina e amida, como destacado na imagem abaixo. Como esses dois grupos possuem característica básica ou alcalina, a cafeína também apresenta essa característica, significando que soluções aquosas de cafeína têm pH acima de 7.
Por Ana Luiza Lorenzen Lima
Professora de Química