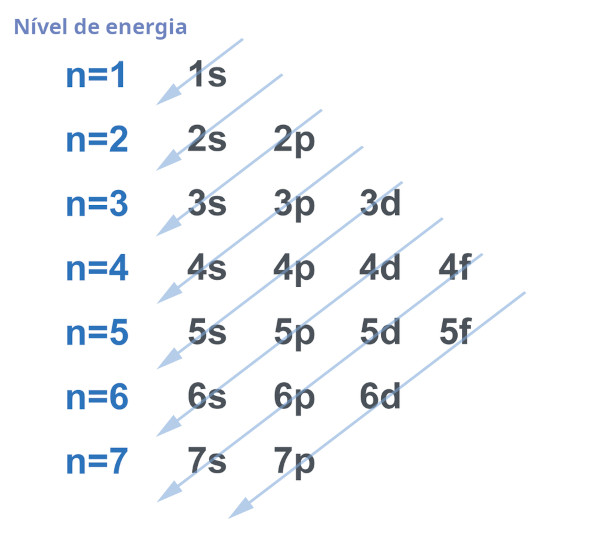
A distribuição eletrônica é a representação da quantidade de elétrons presentes em cada camada (ou nível de energia) e em cada orbital atômico em um átomo. Nesse sentido, os princípios que regem a distribuição eletrônica incluem: o princípio de Aufbau, que determina a ordem em que os elétrons preenchem os diferentes níveis e subníveis de energia; o princípio da exclusão de Pauli, que estabelece que cada orbital pode conter, no máximo, dois elétrons com spins opostos; e a regra de Hund, que rege a distribuição dos elétrons nos orbitais de um mesmo subnível antes de emparelhá-los.
Leia também: Camada de valência — a camada mais externa de um átomo
Tópicos deste artigo
- 1 - Resumo sobre distribuição eletrônica
- 2 - Videoaula sobre distribuição eletrônica
- 3 - O que é distribuição eletrônica?
- 4 - Camadas eletrônicas ou níveis de energia
- 5 - Como fazer a distribuição eletrônica?
- 6 - Diagrama de Linus Pauling
- 7 - Distribuição eletrônica e Tabela Periódica
- 8 - Mapa mental sobre distribuição eletrônica
- 9 - Exercícios resolvidos sobre distribuição eletrônica
Resumo sobre distribuição eletrônica
- Distribuição eletrônica é a maneira como os elétrons estão organizados nos átomos.
- Três princípios regem a distribuição eletrônica:
- princípio de Aufbau: os elétrons preenchem primeiro as camadas mais próximas do núcleo;
- regra de Hund: elétrons em orbitais de igual energia preferem ficar sozinhos antes de formar pares;
- regra da exclusão de Pauli: dois elétrons em um átomo não podem ter os mesmos quatro números quânticos.
- As camadas eletrônicas ou níveis de energia são como andares, onde os elétrons residem ao redor do núcleo.
- O diagrama de Linus Pauling é a representação visual da distribuição eletrônica que organiza os elétrons em níveis e subníveis de energia.
- O número atômico de um elemento indica quantos elétrons ele possui.
- A posição de um elemento na Tabela Periódica fornece informações sobre sua distribuição eletrônica.
Videoaula sobre distribuição eletrônica
O que é distribuição eletrônica?
A distribuição eletrônica é a maneira como os elétrons, aquelas pequenas partículas carregadas negativamente que circulam ao redor do núcleo de um átomo, ocupam diferentes espaços ao redor do núcleo. No entanto, essa organização não é aleatória, segue regras específicas que nos ajudam a entender a química dos elementos.
Além disso, a distribuição eletrônica funciona como uma ferramenta fundamental para explicar as propriedades periódicas dos elementos na Tabela Periódica, como a tendência de se aumentarem a eletronegatividade e a afinidade eletrônica à medida que se move da esquerda para a direita e de se diminuir a eletronegatividade ao descer-se nos grupos. Sem contar que é crucial para compreender como os átomos formam ligações químicas e interagem para criar moléculas e compostos químicos.
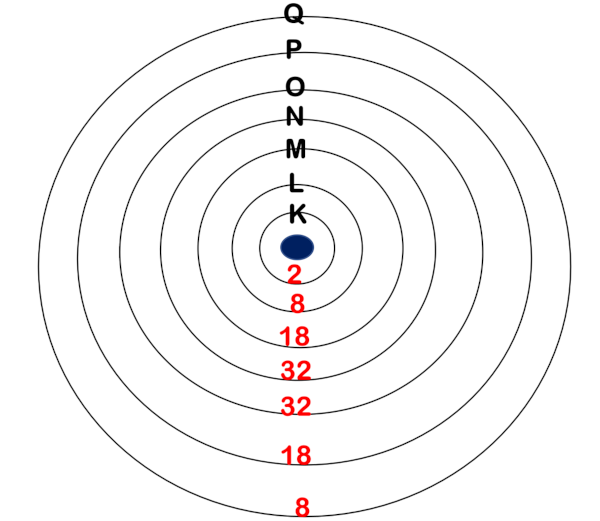
Camadas eletrônicas ou níveis de energia
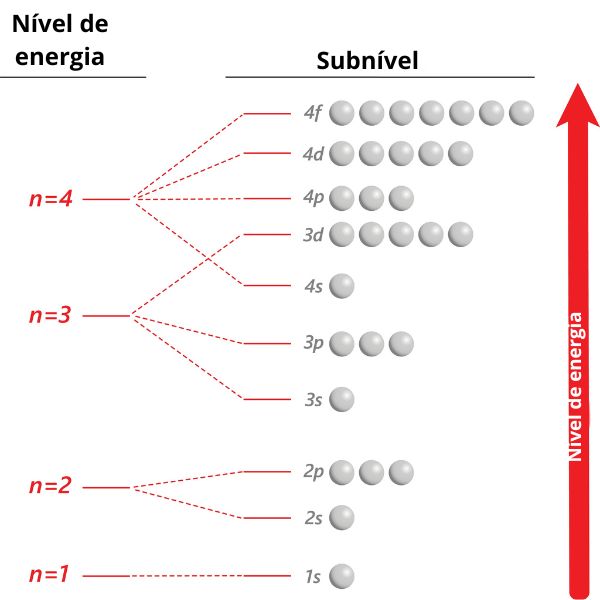
Os níveis de energia, também conhecidos como camadas eletrônicas, são como órbitas ou níveis de órbita ao redor do núcleo de um átomo, onde os elétrons são encontrados. Sendo assim, cada átomo tem diferentes níveis de energia, numerados a partir do núcleo e representados por números inteiros (1, 2, 3, 4 etc.). Às vezes, esses níveis de energia também são representados pelas letras K, L, M, N, O, P, Q, correspondendo aos números 1, 2, 3, 4, 5, 6, 7 respectivamente, conforme a imagem abaixo.
Cada camada eletrônica possui uma capacidade máxima de elétrons que influencia na estabilidade do átomo.
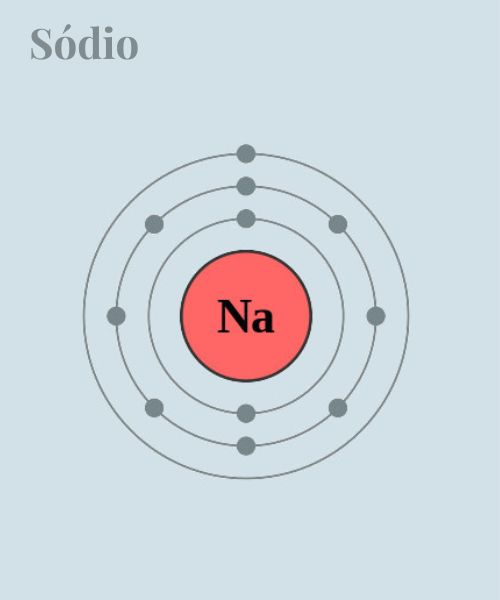
Outro conceito importante é o de camada de valência, a camada mais externa de um átomo e que contém os elétrons mais energeticamente envolvidos em reações químicas. Dessa forma, ela determina as propriedades químicas do elemento. Por exemplo, para o hidrogênio (H), que tem um elétron, a camada de valência é a camada K (nível de energia 1); enquanto, para o sódio (Na), que tem 11 elétrons, a camada de valência é a camada M (nível de energia 3).
Em resumo, cada camada tem um limite máximo de elétrons que pode conter:
Camada K: até 2 elétrons.
Camada L: até 8 elétrons.
Camada M: até 18 elétrons.
Camada N: até 32 elétrons.
Camada O: até 32 elétrons.
Camada P: até 18 elétrons.
Camada Q: até 8 elétrons.
Uma vez que sabemos os conceitos de níveis de energia e camada de valência, fica mais fácil entendermos como funciona a distribuição eletrônica nos elementos.
Como fazer a distribuição eletrônica?
Para distribuir os elétrons em torno do núcleo de um átomo, precisamos conhecer alguns parâmetros, como o princípio de Aufbau, e seguir algumas regras, como a de Hund e a de exclusão de Linus Pauling. Vamos, a seguir, explorar cada um deles.
1. Princípio de Aufbau
Esse princípio nos diz que os elétrons entram primeiro nas camadas mais próximas do núcleo antes de ocuparem as camadas mais externas. Agora pense nas camadas como se fossem degraus em uma escada: você sobe um degrau de cada vez. Sendo assim, o princípio de Aufbau é como uma regra de construção para os elétrons em átomos. Imagine que estamos construindo um prédio de vários andares, mas, em vez de tijolos, estamos usando elétrons. Aqui está como funciona:
- Andares em ordem crescente: começamos construindo o primeiro andar, que é o mais próximo do núcleo do átomo. Chamamos esse andar de camada K. É como se fosse o térreo do nosso prédio.
-
- Adicionando elétrons de baixa energia primeiro: quando começamos a colocar elétrons nessa camada, colocamos os de menor energia primeiro. Isso é como alocar os quartos mais próximos da entrada do prédio antes dos mais distantes. Os elétrons gostam de estar o mais próximo possível do núcleo, pois é onde se sentem mais estáveis.
- Subindo para os próximos andares: depois de construir o térreo, a camada K (n = 1), começamos a construir o segundo andar, a camada L (n = 2). Mais uma vez, adicionamos elétrons de menor energia primeiro. Isso continua à medida que subimos para andares superiores (camadas M, N, e assim por diante).
O princípio de Aufbau nos ajuda a entender por que os elétrons ocupam diferentes camadas ao redor do núcleo de um átomo. É como se eles se acomodassem em cada camada de acordo com sua energia, começando do térreo e subindo conforme necessário.
Lembre-se de que, à medida que adicionamos elétrons, é importante seguir essa ordem, pois isso influencia o comportamento químico dos átomos e como eles se combinam para formar substâncias. O princípio de Aufbau é uma regra fundamental para entender a distribuição eletrônica nos átomos e, consequentemente, a química como um todo.
2. Regra de Hund
A regra de Hund é como um guia para os elétrons que estão sendo alocados nos orbitais de um átomo (regiões com alta probabilidade de se encontrar um ou mais elétrons ao redor de um átomo). Ela nos diz como eles irão se comportar quando estiverem em orbitais com a mesma energia.
Quando existem vários orbitais com a mesma energia (chamados de subníveis), os elétrons tendem a preenchê-los antes de formar pares. Sendo assim, imagine esses orbitais como assentos em um ônibus: eles preferem sentar-se sozinhos antes de dividirem o assento com alguém.
Existem vários tipos de orbitais atômicos, cada um com sua forma característica, como os orbitais s, p, d e f. Eles se diferem em termos de forma e orientação. Sendo assim, imagine que cada bolha representada nos orbitais da imagem anterior é uma região no espaço atômico onde há probabilidade de se encontrar elétrons.
Diante disso, vale ressaltar que, embora as funções de onda nos ajudem a descrever o formato de um orbital atômico, a forma adotada para fazer a distribuição eletrônica de forma didática é a dos blocos de energia, como pode ser visto na figura a seguir:
Diante disso, aqui estão alguns pontos-chave dessa regra:
- Orbitais de igual energia (subníveis): primeiro, você precisa entender que existem diferentes tipos de orbitais (como s, p, d e f) que têm a mesma energia. Por exemplo, no subnível p, temos três orbitais que são todos do mesmo tipo e têm a mesma energia.
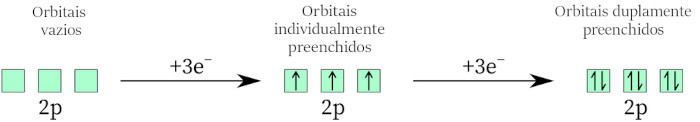
- Elétrons desordenados: a regra de Hund nos diz que, quando temos vários elétrons para colocar em orbitais de igual energia, eles preferem se distribuir de forma desordenada ao invés de formar pares nos orbitais, conforme o exemplo a seguir.
Os orbitais 2p de mesma energia são preenchidos com elétrons desemparelhados, e, à medida que mais elétrons são adicionados, ocorre o emparelhamento.
Diante disso, vamos considerar alguns exemplos práticos dos átomos de boro (Z = 5), carbono (Z = 6), nitrogênio (Z = 7) e oxigênio (Z = 8). Antes, vale lembrar que cada um deles possui dois elétrons no orbital 1s (1s2) e mais dois no orbital 2s (2s2), de modo que os elétrons restantes são distribuídos nos orbitais 2p, onde as setas para cima (↑) e para baixo (↓) representam spins (sentido de rotação) dos elétrons.
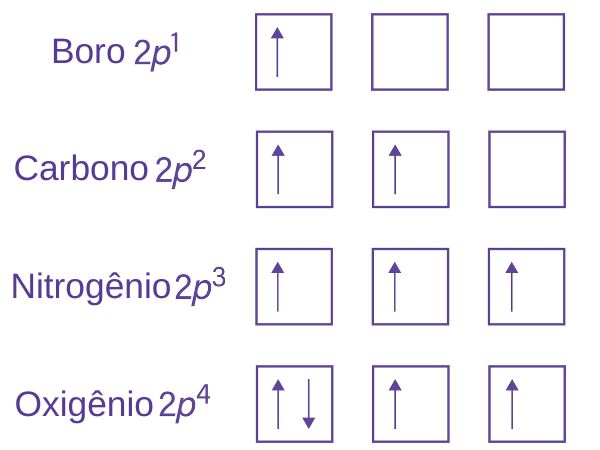
Dessa forma, quando um orbital é preenchido com dois elétrons, eles são representados dessa forma (↑↓) para sinalizar que possuem spins opostos. Vale destacar que cada um dos três orbitais do subnível p recebeu um elétron antes de qualquer orbital receber o segundo elétron. Sendo assim, essa regra mostra que os elétrons tendem a ocupar seus próprios lugares nos orbitais antes de se juntarem em pares. Isso ajuda a entender melhor a configuração eletrônica de átomos e como eles se comportam quimicamente.
3. Regra da exclusão de Pauli
A regra da exclusão de Pauli traz a premissa de que cada elétron é único e possui um conjunto exclusivo de números quânticos que o identificam. Isso significa que não pode haver dois elétrons no mesmo átomo com todos os quatro números quânticos idênticos. Sendo assim, é como se cada elétron tivesse um bilhete de identidade próprio.
Para entendermos melhor essa regra, antes, vamos lembrar o que são os números quânticos. Trata-se de um conjunto de valores que descrevem as características específicas dos elétrons em um átomo, ajudando a localizar e descrever a distribuição dos elétrons em torno do núcleo. Existem quatro números quânticos principais:
- Número quântico principal (n): descreve o nível de energia ou a camada em que um elétron está localizado. Ele determina o tamanho médio da órbita do elétron. Valores de n começam a partir de 1 e se aumentam em incrementos inteiros.
- Número quântico secundário ou azimutal (l): está relacionado com a forma do orbital atômico em que o elétron se encontra. Ele define os subníveis de energia dentro de cada nível principal. Os valores de l variam de 0 a n-1, em que n é o número quântico principal. Para l = 0, o subnível é chamado de s (esférico); para l = 1, é chamado de p (lóbulos); para l = 2, é chamado de d (dísporos); e para l = 3, é chamado de f (formato complexo).
- Número quântico magnético (ml): descreve a orientação espacial específica do orbital dentro de um subnível. Ele varia de -l a +l, incluindo 0. Portanto, um subnível p com l = 1 tem três valores possíveis para ml: -1, 0 e 1. De forma simplificada, os valores de l e ml podem ser representados nos blocos da pirâmide a seguir (à esquerda). Ela mostra os orbitais onde serão distribuídos os elétrons, cujo preenchimento acontece da esquerda para a direita.
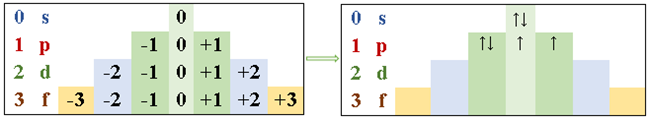
Na pirâmide da direita, temos um exemplo de preenchimento do orbital p para uma configuração eletrônica: 1s2. 2s2, 2p4. Em que 4 é número de elétrons a serem preenchidos no orbital p. Nesse caso, l assume o valor de 1 e ml, de -1.
- Número quântico de spin (ms): indica a orientação do spin do elétron. Ele pode ter apenas dois valores: +1/2 (spin para cima) ou -1/2 (spin para baixo). Isso está relacionado ao princípio de Pauli, que afirma que cada orbital pode conter, no máximo, dois elétrons com spins opostos.
O spin indica o sentido de rotação do elétron em torno do átomo e pode ser sinalizado pelos sinais de + ou –.
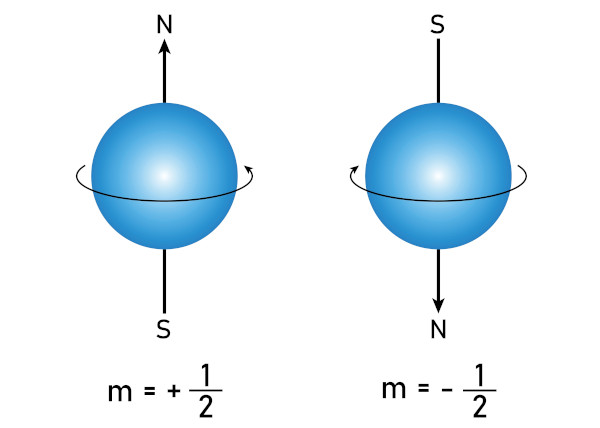
Sendo assim, ainda sobre o exemplo anterior (1s2, 2s2, 2p4), teríamos ms igual a -1/2, já que a seta ficou para baixo, representando o sentido de rotação do último elétron alocado. Dessa forma, os números quânticos para o elétron de valência do sódio são:
n = 2
l = 1
ml = -1
ms = -1/2
A notação da distribuição eletrônica nos fornece essas informações de forma simplificada. Todavia, é necessário desenhar os blocos da pirâmide quando queremos saber os números quânticos ml e ms. Veja, na imagem a seguir, o significado de cada símbolo.
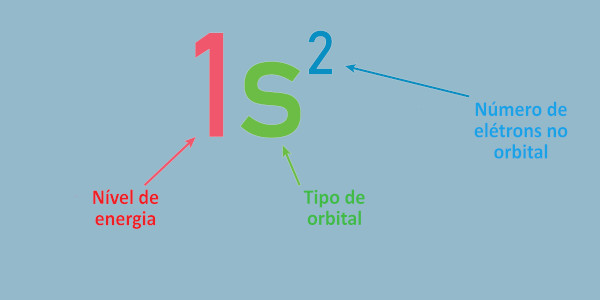
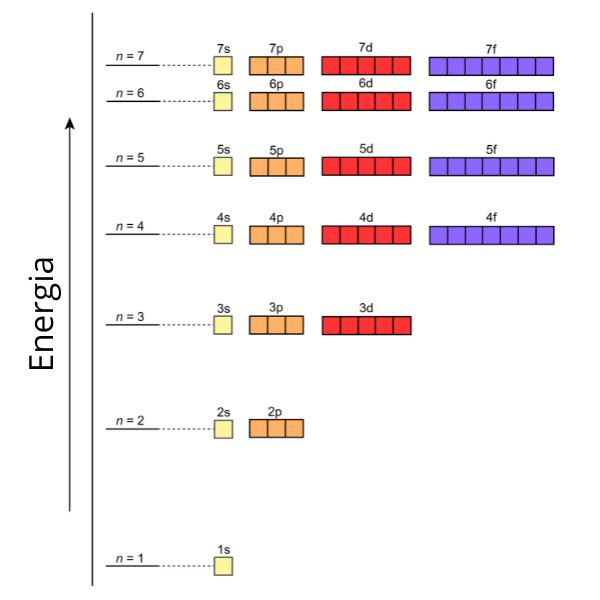
Diagrama de Linus Pauling
O diagrama de Linus Pauling é uma maneira visual de representar a distribuição eletrônica de um átomo. Ele organiza os elétrons em níveis e subníveis de energia de forma simples e clara, funcionando como um mapa que nos ajuda a encontrar os elétrons em um labirinto atômico. Para obedecer à ordem de preenchimento de cada nível e subnível, basta seguir o sentido das setas no diagrama, conforme é mostrado na figura a seguir:
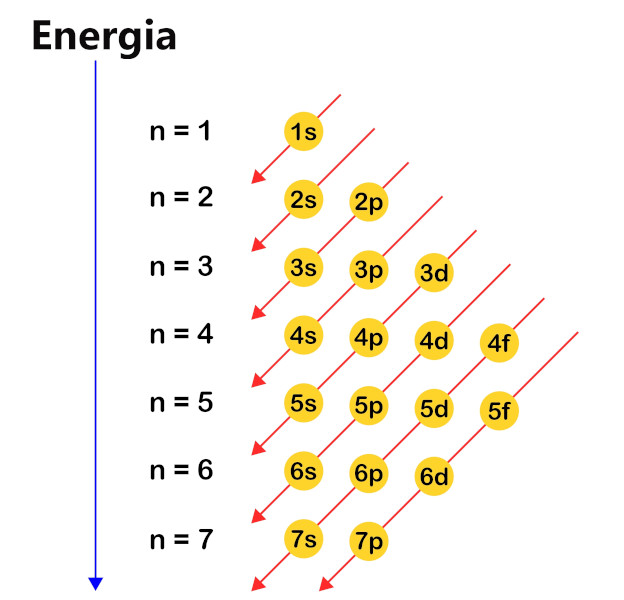
Sendo assim, ao obedecer à ordem de preenchimento dos níveis e subníveis indicada pelo diagrama, o átomo de ferro (Fe), que possui 26 elétrons, terá a distribuição eletrônica da seguinte forma: 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d6. Nesse caso, a camada de valência do átomo de ferro é n = 4 e o subnível mais energético é o d. Essas informações são cruciais para compreensão e organização dos elementos químicos.
Distribuição eletrônica e Tabela Periódica
A distribuição eletrônica está intimamente relacionada com a Tabela Periódica dos elementos, pois cada elemento químico na tabela possui um número atômico único, que nos diz quantos elétrons ele tem. Além disso, a posição de um elemento na tabela nos fornece informações sobre sua distribuição eletrônica ou vice-versa, como podemos visualizar na imagem a seguir:
O subnível onde orbita os elétrons mais energéticos no átomo indica o bloco ao qual ele pertence na Tabela Periódica.
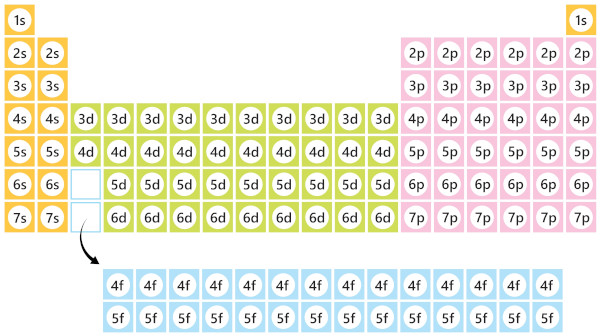
Como visto na imagem, é possível identificar o bloco (s, p, d, f) da tabela ao qual um elemento químico pertence com base na sua configuração eletrônica. Usaremos novamente o exemplo do átomo de ferro citado no tópico anterior, ele possui a seguinte configuração eletrônica: 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d6. O subnível mais energético é o d, que nos indica o bloco ao qual o elemento pertence, e o nível mais externo é 4, o qual revela o período na tabela onde o elemento está localizado.
Além disso, ao somarmos os elétrons do subnível mais energético (d) com os da camada mais externa (4s2 e 3d6), 2 + 6 = 8, encontramos o grupo a que esse elemento faz parte, nesse caso, é o 8 (esse método é aplicado somente para os elementos do bloco d). Sendo assim, o ferro está localizado no bloco d, grupo 8 e 4º período da Tabela Periódica, conforme pode ser visto a seguir.
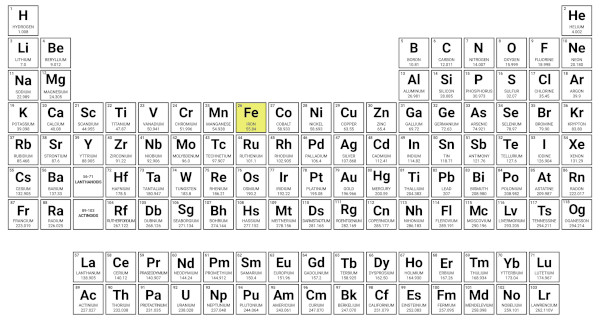
Por fim, ao compreendermos a distribuição eletrônica, conseguimos localizar os átomos na tabela, identificar os grupos aos quais pertencem, e prever os tipos de ligação (covalente, iônica ou metálica) que eles realizarão.
Mapa mental sobre distribuição eletrônica
.jpeg)
* Baixe o mapa mental sobre distribuição eletrônica!
Exercícios resolvidos sobre distribuição eletrônica
Questão 1 (Enem 2018) Na mitologia grega, Nióbia era a filha de Tãntalo, dois personagens conhecidos pelo sofrimento. O elemento químico de número atômico (Z) igual a 41 tem propriedades químicas e físicas tão parecidas com as do elemento de número atômico 73 que chegaram a ser confundidos. Por isso, em homenagem a esses dois personagens da mitologia grega, foi conferido a esses elementos os nomes de nióbio (Z = 41) e tântalo (Z = 73). Esses dois elementos químicos adquiriram grande importância econômica na metalurgia, na produção de supercondutores e em outras aplicações na indústria de ponta, exatamente pelas propriedades químicas e físicas comuns aos dois.
KEAN, S. A colher que desaparece: e outras histórias reais de loucura, amor e morte a partir dos elementos químicos. Rio de Janeiro: Zahar, 2011 (adaptado).
A importância econômica e tecnológica desses elementos, pela similaridade de suas propriedades químicas e físicas, deve-se a:
- terem elétrons no subnível f.
- serem elementos de transição interna.
- pertencerem ao mesmo grupo na Tabela Periódica.
- terem seus elétrons mais externos nos níveis 4 e 5 respectivamente.
- estarem localizados na família dos alcalinos terrosos e alcalinos respectivamente.
Gabarito: C
Além de o texto afirmar que esses dois elementos possuem propriedades físicas e químicas semelhantes, o que é característico de elementos de um mesmo grupo, é possível verificar esse fato pelas configurações eletrônicas:
Nb: 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d3
Ta: 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f14, 5d3
Ao somarmos os elétrons da última camada com os da camada anterior, de nível mais energético d (em negrito), encontramos o grupo aos quais eles pertencem: 5.
Questão 2
A regra da exclusão de Pauli traz a premissa de que cada elétron é único e possui um conjunto exclusivo de números quânticos que o identificam. Isso significa que não pode haver dois elétrons no mesmo átomo com todos os quatro números quânticos idênticos. Com base nessa premissa, marque a alternativa que corresponde aos números quânticos para o último elétron a ser preenchido na camada de valência do átomo de cálcio (Ca), cujo número é 20.
a) n = 3; l = 0; ml = 2; ms = -1/2.
b) n = 4; l = 2; ml = -2; ms = -1/2.
c) n = 3; l = 2; ml = 0; ms = -1/2.
d) n = 4; l = 2; ml = -1; ms = 1/2.
e) n = 4; l = 0; ml = 0; ms = -1/2.
Gabarito: E
Ao fazermos a distribuição eletrônica do Ca (Z = 20), temos: 1s2, 2s2, 2p6, 3s2, 3p6, 4s2. Sendo assim, os números quânticos para o último elétron a ser preenchido são:
n = 4 (Última camada)
l = 0 (O formato do orbital s equivale a 0.)
ml = 0 (O valor atribuído ao subnível s é somente o 0.)
ms = -1/2 (O elétron é preenchido com a seta para baixo.)
Créditos da imagem
[1] Wikimedia Commons (texto na imagem traduzido)
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. O princípio da construção. In: Princípios de Química: Questionando A Vida Moderna e o Meio Ambiente. 7. ed. [s.l.] Bookman, 2018. p. 44–48.
L. BROWN, T. et al. Configurações eletrônicas. In: Química: A Ciência Central. 13. ed. [s.l.] Pearson Education do Brasil., 2016. p. 248–251.
SILVA, A. L. P. et al. Configuração Eletrônica Nos Livros Didáticos De Química Do Pnld 2018-2020: Um Estudo Histórico-Conceitual. Vidya, v. 41, n. 1, p. 163–183, 2021.