O seabórgio, símbolo Sg e número atômico 106, é um elemento químico sintético localizado no grupo 6 da Tabela Periódica. Sua descoberta data de 1974, sendo creditada ao grupo americano liderado por Albert Ghiorso e que tinha a contribuição de Glenn Seaborg, cujo nome originou o termo seabórgio. Assim como muitos elementos dessa região da Tabela Periódica, o seabórgio só teve seu nome oficializado em 1997, por conta de disputas e negociações entre grupos de cientistas.
Embora existam pesquisadores empenhados em estudá-lo, o seabórgio tem pouca utilidade em termos práticos. Isso se dá por causa das dificuldades de síntese de isótopos desse elemento, bem como a baixa estabilidade destes. O isótopo mais estável do seabórgio, por exemplo, tem tempo de meia-vida de aproximadamente cinco minutos.
Veja também: Dúbnio — outro elemento químico sintético do Grupo 6 da Tabela Periódica
Tópicos deste artigo
- 1 - Resumo sobre o seabórgio
- 2 - Propriedades do seabórgio
- 3 - Características do seabórgio
- 4 - Obtenção do seabórgio
- 5 - Precauções com o seabórgio
- 6 - História do seabórgio
- 7 - Exercícios resolvidos sobre o seabórgio
Resumo sobre o seabórgio
- É um elemento químico sintético localizado no grupo 6 da Tabela Periódica.
- Foi sintetizado pela primeira vez em 1974, por dois grupos distintos.
- É um elemento radioativo.
- Ainda não se sabe muito sobre o seabórgio, pois dificilmente são produzidas amostras estáveis em quantidades significativas.
- O elemento foi oficializado como seabórgio apenas em 1997, em homenagem ao cientista Glenn Seaborg.
Propriedades do seabórgio
- Símbolo: Sg.
- Número atômico: 106.
- Massa atômica: 269 u.m.a.
- Configuração eletrônica: 7s2 5f14 6d4.
- Isótopos mais conhecidos: 269Sg (5 ± 3 minutos de meia-vida); 271Sg (3,1 ± 1,6 minutos de meia-vida).
- Série química: grupo 6; transactinídeos; elementos superpesados.
Características do seabórgio
É característico dos elementos transactínideos serem radioativos. Esses são os elementos com número atômico maior ou igual a 104 (a partir do ruterfórdio, Rf). Contudo, houve uma busca desenfreada por esses elementos na natureza e chegou-se a teorizar sobre a “ilha da estabilidade”.

Ela representaria uma região atômica superpesada em que o número de prótons seria, em média, 114, e os elementos possuiriam grande tempo de meia-vida (tempo necessário para a massa da amostra cair pela metade), apresentando-se como viáveis e acessíveis para estudos experimentais.
Porém, por mais que diversos esforços tenham sido feitos desde a década de 1950 para encontrar traços naturais desses elementos, em meados da década de 1980, Georgy Flerov e Gurgen Ter-Akopian afirmaram não ter esperanças de encontrá-los na natureza.
Assim como acontece com outros elementos transactinídeos, há dificuldades para estudar o seabórgio de forma ampla. Isso porque é possível sintetizar apenas poucas quantidades, que possuem tempo de meia-vida muito pequeno, ou seja, são poucos átomos e eles se mantêm por poucos minutos.
Isso possibilitou afirmar que o seabórgio seria, de fato, do grupo 6, como foi o caso do composto SgO2Cl2, que em certos aspectos se assemelhava com os compostos análogos de elementos estáveis do grupo, como WO2Cl2 e MoO2Cl2.
Leia também: Elementos transurânicos — elementos artificiais que vêm depois do urânio na Tabela Periódica
Obtenção do seabórgio
Como o seabórgio é um elemento sintético, é importante destacar que ele não é encontrado na natureza. Uma barreira na obtenção do seabórgio, além do fato de ser possível sintetizar apenas poucas quantidades, é que sua obtenção demanda maquinários de grande tecnologia e condições extremas.
Átomos como o seabórgio são formados a partir da reação de fusão de átomos mais leves utilizando raios iônicos de altíssima energia e só estão disponíveis para estudo em ambientes considerados hostis para a maioria dos sistemas químicos: utilizando um feixe de plasma induzido em grandes aceleradores de partículas.

Historicamente, o seabórgio foi sintetizado por meio da colisão de íons 18O (oxigênio-18) tendo o 249Cf (califórnio-249) como alvo. Assim, por meio da análise dos decaimentos de partículas alfa, comprovou-se a síntese do elemento 106.
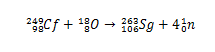
Precauções com o seabórgio
Elementos químicos como o seabórgio não apresentam grandes riscos, pois não são produzidas quantidades suficientes desse elemento que permaneçam estáveis por muito tempo. Todo o cuidado que se deve ter tem relação com as amostras radioativas, capazes de gerar radiações ionizantes nos processos de decaimento.
Saiba mais: Acidente de Chernobyl — o maior acidente nuclear da história
História do seabórgio
Assim como outros elementos superpesados, o seabórgio foi descoberto no contexto da chamada Guerra dos Transférmios, um pedaço da Guerra Fria na história da Química e da Tabela Periódica.
Essa guerra foi uma disputa pela preferência em nomear os elementos químicos descobertos após o férmio (Fm, Z = 100), mais especificamente entre os elementos de número atômico 104 até 109, que ocorreu durante o período da Guerra Fria.
Nessa disputa, rivalizaram os laboratórios:
- Joint Institute for Nuclear Research, em Dubna (antigamente parte da União Soviética);
- Lawrence Berkeley National Laboratory da Universidade da Califórnia, em Berkeley (Estados Unidos);
- Gesellschaft für Schwerionenforschung, em Darmstadt (Alemanha).
Especificamente no caso do seabórgio, a disputa ocorreu entre os laboratórios de Dubna e de Berkeley. Isso porque, em 1974, ambos os laboratórios afirmaram ter conseguido sintetizar o elemento 106.
Contudo, um relatório conjunto que continha membros tanto da União Internacional de Química Pura e Aplicada (Iupac) quanto da União Internacional de Física Pura e Aplicada (Iupap), feito em 1993, concluiu que, embora muito importantes para desenvolvimentos vindouros, os experimentos dos laboratórios de Dubna não demonstravam a formação do elemento 106 de forma convincente, creditando assim aos laboratórios de Berkeley a descoberta do novo elemento.
A Comissão de Nomenclatura de Compostos Inorgânicos (CNIC) da Iupac chegou a propor o nome de rutherfórdio para o elemento 106, desconsiderando as propostas dos pesquisadores. Depois de muitas discussões, o time dos laboratórios de Berkeley, liderado por Albert Ghiorso, decidiu, quanto ao nome, homenagear o colega Glenn Theodore Seaborg, Prêmio Nobel de Química de 1951, nomeando o elemento de seabórgio.
Seu filho Eric Seaborg chegou a contar, em um artigo, a reação do pai ao saber da ideia:
Ghiorso se aproximou dos membros da equipe, um por um, até que sete deles assentiram. Ele então disse a seu amigo e colega por 50 anos: “Nós temos sete votos favoráveis a nomear o elemento 106 como seabórgio. Você aceitaria?”. Meu pai ficou atônito e, depois de consultar a minha mãe, aceitou.
Exercícios resolvidos sobre o seabórgio
Questão 1
O seabórgio possui um isótopo, de massa 269, cujo tempo de meia-vida estimado é de 5 minutos. Em um experimento para sua síntese, os cientistas conseguiram detectar, após 25 minutos, 0,0025 mg do isótopo 269 do seabórgio. A massa inicial de seabórgio era de:
A) 0,0025 mg
B) 0,0050 mg
C) 0,0100 mg
D) 0,0200 mg
E) 0,0800 mg
Resolução:
Alternativa E
O tempo de meia-vida é o tempo necessário para que a quantidade de uma amostra radioativa caia pela metade. Em 25 minutos, ocorreram 5 tempos de meia-vida do seabórgio. Assim, é possível fazer uma análise retroativa:
- 0,0050 mg para 0,0025 mg (5ª meia-vida)
- 0,0100 mg para 0,0050 mg (4ª meia-vida)
- 0,0200 mg para 0,0100 mg (3ª meia-vida)
- 0,0400 mg para 0,0200 mg (2ª meia-vida)
- 0,0800 mg para 0,0400 mg (1ª meia-vida)
Questão 2
Em 1974, em Berkeley, Califórnia, o grupo liderado por Albert Ghiorso conseguiu sintetizar o elemento 106, durante a conhecida Guerra dos Transférmios, um pedaço da Guerra Fria na história da Química. Esse novo elemento possuía, além de número atômico 106, um número de massa de 263. Em 1997, ele foi oficializado como seabórgio, em referência ao amigo e colega de Ghiorso Glenn Seaborg, laureado com o Prêmio Nobel de Química de 1951 e também participante do grupo que conseguiu sintetizar o novo elemento.
A partir dos dados apresentados, é possível concluir que o número de nêutrons do seabórgio sintetizado é igual a:
A) 155
B) 157
C) 159
D) 106
E) 263
Resolução:
Alternativa B
O número de nêutrons de um átomo pode ser calculado da seguinte forma:
A = Z + n
A é o número de massa, Z é o número atômico e n é o número de nêutrons.
Substituindo os dados fornecidos pela questão, temos:
263 = 106 + n
n = 157
Por Stéfano Araújo Novais
Professor de Química

