Uma reação de oxirredução é caracterizada como um processo simultâneo de perda e ganho de elétrons, pois os elétrons perdidos por um átomo, íon ou molécula são imediatamente recebidos por outros.
Para entender, veja um exemplo:
Uma solução de sulfato de cobre (CuSO4(aq)) é azul em razão da presença de íon Cu2+ dissolvidos nela. Se colocarmos uma placa de zinco metálico (Zn(s)) nessa solução, com o passar do tempo poderemos notar duas modificações: a cor da solução ficará incolor e aparecerá um depósito de cobre metálico na placa de zinco.
.jpg)
Portanto, a reação que ocorre nesse caso é a seguinte:
Zn(s) + CuSO4(aq) → Cu(s) + ZnSO4(aq)
ou
Zn(s) + Cu2+(aq) + SO42-(aq) → Cu(s) + Zn2+(aq) + SO42-(aq)
ou ainda
Zn(s) + Cu2+(aq) → Cu(s) + Zn2+(aq)
Observe que houve uma transferência de elétrons do zinco para o cobre. Analisando isoladamente a transformação que ocorreu em cada um desses elementos, temos:
- Zn(s) → Zn2+(aq)
O zinco perdeu 2 elétrons passando de zinco metálico para cátion. Nesse caso, o zinco sofreu uma oxidação.
- Cu2+(aq) → Cu(s)
Já com o cobre ocorreu o contrário, ele ganhou 2 elétrons, passando de cátion cobre II para cobre metálico. O cobre sofreu uma redução.
Isso explica as duas mudanças observadas, pois a solução ficou incolor porque os íons cobre se transformaram em cobre metálico, que se depositaram na placa de zinco.
Visto que houve uma perda e um ganho de elétrons simultâneos, essa reação é um exemplo de reação de oxirredução, e por meio dela podemos estabelecer os seguintes conceitos que se repetem para todas as outras reações desse tipo:

O metal mais reativo sofre a oxidação, assim, no exemplo proposto o zinco é mais reativo que o cobre.
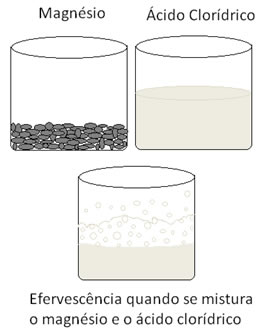
Outra reação de oxirredução que pode ser citada ocorre quando colocamos magnésio ou alumínio em uma solução de ácido clorídrico. Nessas reações o hidrogênio do ácido clorídrico recebe 3 elétrons vindos do alumínio (ou 2 elétrons vindos do magnésio), passando de cátion H+ para gás hidrogênio (H2), enquanto que o metal se transforma no cátion:
2 Al(s) + 6 H+(aq) → 2 Al3+(aq) + 3H2 (g)
Mg(s) + 2 H+(aq) → Mg2+(aq) + H2 (g)
Os metais sofrem oxidação e o hidrogênio sofre redução. Abaixo temos uma figura que mostra que ao se adicionar o magnésio no ácido clorídrico ocorre uma efervescência, que é em razão da liberação do gás hidrogênio, e o magnésio desaparece, pois é consumido.
Por Jennifer Fogaça
Graduada em Química
