Os estudantes do ensino médio estão sempre sujeitos a encarar reações de oxirredução com íons, tanto em provas de vestibulares quanto no Exame Nacional do Ensino Médio (Enem). Assim, o balanceamento dessas equações pode ser um conteúdo de estudo muito temido.
Com o objetivo de facilitar a compreensão desse assunto, este texto procura abordar o balanceamento de equações de oxirredução com íons com a descrição de alguns passos para realizá-la. Para isso, devemos iniciar pela identificação desse tipo de reação química.
As reações de oxirredução com íons são identificadas pela presença de um ou mais componentes com cargas (positiva ou negativa), ou seja, os íons (cátions ou ânions), que podem apresentar-se nos reagentes ou nos produtos, como nos dois exemplos a seguir:
1º Exemplo: Cr2O72- + Fe2+ + H+ → Cr3+ + Fe3+ + H2O
2º Exemplo: Cl2 + C + H2O → CO2 + H+ + Cl-
Para realizar o balanceamento de equações das reações de oxirredução com íons, é fundamental seguir alguns passos, como:
-
1º Passo: determinar o NOX de cada um dos átomos dos reagentes e produtos da equação;
Não pare agora... Tem mais depois da publicidade ;) -
2º Passo: verificar qual é a espécie que sofreu oxidação;
-
3º Passo: determinar a variação do NOX da espécie que sofreu oxidação;
-
4º Passo: multiplicar a variação encontrada no terceiro passo pelo número de átomos da espécie que oxida;
-
5º Passo: verificar qual é a espécie que sofreu redução;
-
6º Passo: determinar a variação do NOX da espécie que sofreu redução;
-
7º Passo: multiplicar a variação encontrada no terceiro passo pelo número de átomos da espécie que reduz;
Não pare agora... Tem mais depois da publicidade ;) -
8º Passo: utilizar o valor encontrado no quarto passo como coeficiente da espécie que reduz;
-
9º Passo: utilizar o valor encontrado no sétimo passo como coeficiente da espécie que oxida;
-
10º Passo: colocar os coeficientes nas outras espécies, de acordo com o método de balanceamento por tentativa. Naquelas espécies em que não for possível fazer isso, colocar incógnitas como coeficientes;
-
11º Passo: multiplicar o coeficiente de cada espécie pela sua carga;
-
12º Passo: igualar a somatória de cargas dos reagentes com a dos produtos para encontrar o coeficiente de uma das espécies com incógnitas;
-
13º Passo: finalizar o balanceamento com a utilização do método da tentativa.
Não pare agora... Tem mais depois da publicidade ;)
Visando facilitar o entendimento, acompanhe o passo a passo descrito acima, no seguinte exemplo de uma equação de oxirredução com íons:
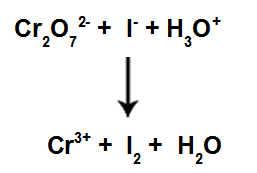
Equação iônica apresentando alguns íons e grupos de carga geral 0
1º Passo: NOX de cada átomo.
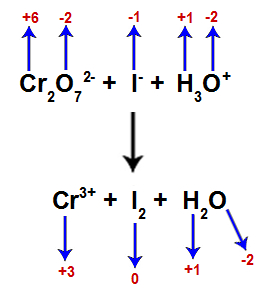
NOX dos átomos presentes na equação
2º Passo: Espécie que sofre oxidação.
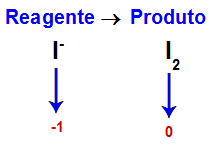
Espécie que sofre oxidação na equação
Como o NOX do iodo aumenta de -1 para 0, do reagente para o produto, ele é, portanto, a espécie que sofre a oxidação.
3º Passo: Determinar a variação do NOX da espécie que sofreu oxidação.
Para isso, basta subtrair o NOX maior pelo NOX menor:
∆NOX = (0) – (-1)
∆ NOX = 0 + 1
∆ NOX = 1
4º Passo: Multiplicação do NOX pela quantidade.
Nesse passo, multiplicamos a variação encontrada no terceiro passo pela quantidade de átomos da espécie.
I- = ∆NOX.1
I- = 1.1
I- = 1
5º Passo: Espécie que sofre redução.
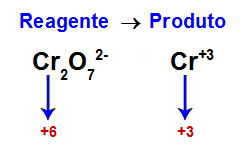
Espécie que sofre redução na equação
Como o NOX do cromo diminui de +7 para +3, do reagente para o produto, ele é, portanto, a espécie que sofre a redução.
6º Passo: Determinar a variação do NOX da espécie que sofreu redução.
Para isso, basta subtrair o NOX maior pelo NOX menor:
∆NOX = (+6) – (+3)
∆ NOX = +6 – 3
∆ NOX = 3
7º Passo: Multiplicação do NOX pela quantidade.
Nesse passo, multiplicamos a variação encontrada no sexto passo pela quantidade de átomos da espécie.
Cr2O72- = ∆NOX.1
Cr2O72- = 3.2
Cr2O72- = 6
8º Passo: Iniciar o balanceamento.
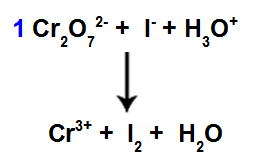
Início do balanceamento utilizando coeficiente encontrado
Nesse passo, iniciamos o balanceamento ao colocar o coeficiente encontrado no quarto passo na espécie que sofreu redução.
9º Passo: Continuar o balanceamento.
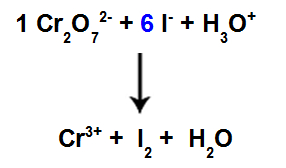
Continuação do balanceamento com a utilização do coeficiente encontrado
10º Passo: Utilizar o método da tentativa.
-
Existem 6 átomos de I no reagente, portanto, devemos colocar o coeficiente 3 na espécie I2 do produto, porque nele existem apenas 2 átomos de Cl;
-
Como na espécie 1, Cr2O72-, há 2 átomos de Cr, devemos colocar o coeficiente 2 na espécie Cr3+ do produto.
Como temos oxigênio em três espécies, e em duas delas não há coeficientes, para prosseguir o balanceamento, devemos colocar incógnitas nas espécies restantes:
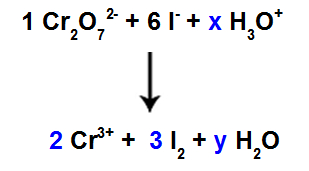
Coeficientes após a utilização do método da tentativa
11º Passo: Multiplicação de cada espécie por sua carga.
Para isso, basta multiplicar o coeficiente da espécie pela sua carga, da seguinte forma:
-
Nos reagentes:
Cr2O72- = 1.(-2) = -2
I- = 6.(-1) = -6
H3O+ = x.(+1) = +x
-
Nos produtos:
Cr3+ = 2.(+3) = +6
I2 = 4.0 = 0
H2O = y.0 = 0
12º Passo: Somatória das cargas.
Nesse passo, devemos somar as cargas dos reagentes e produtos encontradas no 11º passo:
Reagentes = produtos
-2 + (-8) + (+x) = +6 + 0 + 0
-2 – 6 + x = 6
-8 + x = 6
x = 6 + 8
x = 14
13º Passo: Término do balanceamento.
Para finalizar o balanceamento, devemos:
-
Colocar o resultado encontrado no 12º passo na espécie H3O+;
-
Como passamos a ter 42 átomos de H no reagente, é necessário colocar o coeficiente 21 na espécie H2O no produto.
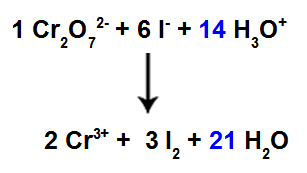
Equação da reação iônica balanceada
Por Me. Diogo Lopes Dias
