A principal característica que distingue as reações de oxirredução é que simultaneamente uma espécie química perde elétrons (oxidando) e outra ganha elétrons (reduzindo).
No entanto, em determinadas reações é possível observar que não ocorre somente uma oxidação e/ou redução. Abaixo temos um exemplo:
SnS + HCl + HNO3 → SnCl4 + S + NO +H2O
Calculando os números de oxidação (Nox) de todos os átomos dessa reação, conforme ensinado no texto “Determinação do Número de Oxidação (Nox)”, temos:
+2 -2 +1 -1 +1 +5 -2 +4 -1 0 +2 -2 +1 -2
SnS + HCl + HNO3 → SnCl4 + S + NO +H2O
Vamos verificar agora quais substâncias sofreram variações nos seus Nox e, consequentemente, quais oxidaram e reduziram:
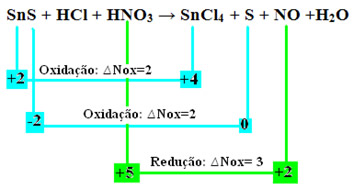
Observe que ocorreram duas oxidações. Então, nesse caso, como realizar o balanceamento da equação química?
Uma coisa importante que temos de ter em mente e que vale para todas as reações de oxirredução é que o número de elétrons cedidos sempre tem que ser igual ao número de elétrons recebidos.
Portanto, para balancear esse tipo de reação, seguem-se as mesmas regras estabelecidas no texto “Balanceamento por oxirredução”, porém, com apenas uma alteração: a determinação da variação do Nox (∆Nox) da espécie que gerou as duas oxidações (SnS) será a soma dos dois ∆Nox, que nos dará o valor total de elétrons perdidos:
- SnS: ∆Nox total = (∆Nox SnCl4) + (∆Nox S)
SnS: ∆Nox total = 2 + 2 = 4
- HNO3: ∆Nox = 3
Assim, podemos seguir com os passos seguintes para o balanceamento:
- SnS: ∆Nox total = 4 → 4 será o coeficiente de HNO3;
- HNO3: ∆Nox = 3 → 3 será o coeficiente de SnS.
3 SnS + HCl + 4 HNO3 → SnCl4 + S + NO +H2O
Continuando o balanceamento pelo método de tentativas:
- Visto que tem 3 Sn e 3 S no 1º membro, esses também serão seus coeficientes no 2º membro:
3 SnS + HCl + 4 HNO3 → 3 SnCl4 + 3 S + NO +H2O
- Com isso, o 2º membro ficou com 12 Cl (3 . 4 = 12), portanto 12 será o coeficiente da substância em que o Cl se encontra no 1º membro, que é o HCl:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NO +H2O
- Agora temos 16 H no 1º membro (12 + 4 = 16), por isso, o coeficiente de H2O será igual a 8, pois 8 multiplicado pelo índice do hidrogênio, que é 2, dá 16:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NO +8H2O
- Além disso, no 1º membro também tem 4 N, assim 4 também será o coeficiente do N no 2º membro:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + 4 NO +8 H2O
Observe que a quantidade de oxigênios no 1º membro (3 . 4 = 12) é igual à quantidade total desse elemento no 2º membro (4 + 8 = 12). Portanto, a reação está balanceada.
Por Jennifer Fogaça
Graduada em Química
