Ferrugem é uma mancha marrom-avermelhada que surge em superfícies de ferro ou ferrosas quando estão expostas ao ar e à umidade. Como o ferro metálico é instável em contato com o ar, ela se forma pela oxidação do ferro metálico a óxidos ou hidróxidos de ferro, comumente representados pela fórmula química FeOOH.
A ferrugem é um grande problema para a sociedade, pois danifica significativamente estruturas, como pontes, prédios, veículos, motores, entre outras, necessitando de grandes gastos com reparo e manutenção. A ferrugem é um tipo de corrosão, fenômeno espontâneo da destruição de metais e ligas. Atualmente, diversas técnicas, como a galvanização, são utilizadas para diminuir os impactos da formação da ferrugem.
Leia também: Como a maresia está relacionada à corrosão dos metais?
Tópicos deste artigo
- 1 - Resumo sobre ferrugem
- 2 - O que causa a ferrugem?
- 3 - Como ocorre a ferrugem?
- 4 - Tipos de ferrugem
- 5 - Composição química da ferrugem
- 6 - Consequências da ferrugem
- 7 - Como evitar a ferrugem?
- 8 - Qual a diferença entre ferrugem e corrosão?
Resumo sobre ferrugem
-
A ferrugem é caracterizada por manchas marrom-avermelhadas que se formam sobre superfícies de ferro e ligas ferrosas que estão em contato com o ar e a umidade.
-
A ferrugem se forma quando o ferro, instável na presença do oxigênio atmosférico, é oxidado a óxidos e hidróxidos de ferro.
-
Pode ser representada pela fórmula química geral FeOOH.
-
O principal componente da ferrugem é o óxido de ferro III hidratado, Fe2O3∙H2O.
Não pare agora... Tem mais depois da publicidade ;) -
A ferrugem configura um grande problema para países e empresas, visto que os custos com manutenção e reparo são elevados.
-
Causa grandes impactos estruturais, pois fragiliza mecanicamente as estruturas metálicas.
-
Existem técnicas para diminuir ou mitigar a ferrugem, como a proteção catódica e a galvanização.
-
A formação de ferrugem é um tipo de corrosão.
O que causa a ferrugem?
A ferrugem é uma mancha marrom-avermelhada que surge em superfícies metálicas, mais especificamente no ferro e em ligas ferrosas, quando estão expostas à atmosfera ou submersas em águas naturais. Nesse caso, o ferro metálico (Fe) é oxidado a uma mistura de óxidos (Fe2O3∙H2O e Fe3O4) e hidróxidos (Fe(OH)2, Fe(OH)3) de ferro, os quais também são comumente representados pela fórmula FeOOH, que busca condensar todas as fases de ferro presentes na ferrugem.
O processo que ocasiona a ferrugem é quimicamente conhecido como corrosão, consequência da ação do meio sobre um material, levando à sua deterioração, a partir da sua superfície.
Como ocorre a ferrugem?
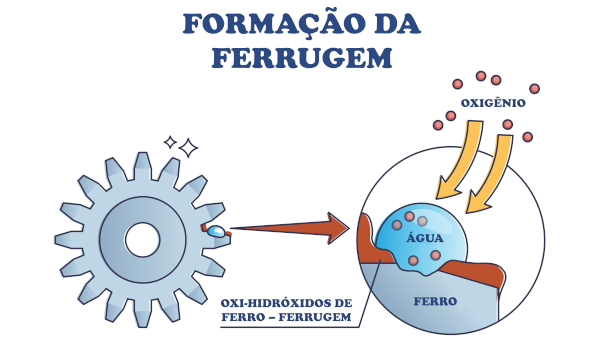
O ferro metálico é termodinamicamente instável na presença do gás oxigênio, o qual constitui cerca de 20% de nossa atmosfera e é o meio em que mais frequentemente tal metal se encontra exposto.
Nessas condições, são mais estáveis suas formas óxidas FeO (óxido de ferro II), Fe2O3 (óxido de ferro III) e Fe3O4 (óxido de ferro II, III). A presença de água torna o meio ainda mais agressivo, favorecendo a formação da ferrugem (FeOOH). Assim como sais básicos e hidróxidos precisam de água para sua formação, a ferrugem, uma mistura de óxidos e hidróxidos, também precisa, deixando claro o papel da umidade relativa do ar:
4 Fe3O4 (s) + O2 (g) + 6 H2O (l) → 12 FeOOH (s)
Já em regiões de alta umidade relativa do ar, é comum a formação da chamada pilha de corrosão, por conta da formação de uma lâmina de água que se condensa (liquefaz) sobre a superfície metálica de forma total ou parcial.
Nesse caso, devemos nos atentar aos potenciais-padrão de redução das espécies envolvidas:
-
Fe2+ (aq)/Fe (s): E° = –0,44 V
Não pare agora... Tem mais depois da publicidade ;) -
Fe3+ (aq)/Fe2+ (aq): E° = 0,77 V
-
O2 (g)/OH– (aq): E° = 0,82 V
Os valores demonstram que é quimicamente espontêneo o processo em que o Fe é oxidado pelo O2 dissolvido na água, já que o ferro apresenta menor potencial-padrão de redução. Assim sendo, temos que:
Fe (s) → Fe2+ (aq) + 2 e–
O2 (g) + 2 H2O (l) + 4 e– → 4OH– (aq)
De forma resumida, a formação de ferrugem pode ser dada como:
2 Fe2+ (aq) + O2 (g) + 4 OH– (aq) → 2 FeOOH (s) + 2 H2O (l)
Embora a concentração de oxigênio no ar seja constante, sua solubilidade em água é baixa (1,4 x 10–3 mol.L–1 H2O a 20 °C), sendo ele rapidamente consumido na superfície do aço (liga metálica formada principalmente por ferro e carbono). Embora reposto constantemente pelo ar, esse oxigênio, a cada instante, deverá passar por uma camada mais espessa de ferrugem para atingir novamente o aço, o que diminui, com o tempo, a velocidade da corrosão.
Tipos de ferrugem

A ferrugem vai variar de coloração a depender da quantidade de oxigênio e umidade.
-
Ferrugem vermelha: rica em Fe2O3∙H2O (óxido de ferro III hidratado), ocorre em ambientes de alta oxigenação e umidade, sendo a forma mais comum, formando-se uniformemente.
-
Ferrugem amarela: rica em FeO(OH)H2O (ou Fe(OH)3), ocorre em ambientes de grande umidade, geralmente em metais encontrados com grandes quantidades de água parada, como próximo de pias e banheiras.
-
Ferrugem preta: rica em Fe3O4, ocorre em ambientes de baixa concentração de oxigênio e umidade moderada. Aparece como manchas pretas, não sendo produzida rapidamente, e, por isso, é de fácil combate.
Não pare agora... Tem mais depois da publicidade ;) -
Ferrugem marrom: rica em Fe2O3, ocorre em ambientes de alta concentração de oxigênio e baixa umidade (até mesmo sem). Por conta disso, é um tipo muito mais seco de ferrugem, não ocorrendo de maneira uniforme, mas sim em pontos específicos da superfície.
Veja também: Quais são os tipos de corrosão?
Composição química da ferrugem
Comumente, diz-se que a ferrugem é composta por óxido de ferro III hidratado (Fe2O3∙H2O), mas pode-se entender que outras espécies de ferro estão presentes em sua composição. Como o ferro é um metal pouco estável em contato com o oxigênio do ar, é normal que as peças desse metal tenham a formação de uma fina camada de Fe3O4 (magnetita) em sua superfície. O constante contato com o oxigênio do ar e a umidade faz surgirem outras espécies oxidadas, como FeOOH, nas formas cristalinas α-FeOOH (goethita) e γ-FeOOH (lepidocrocita). Essas espécies se sobrepõem em camadas ao longo da ferrugem.
Consequências da ferrugem
O processo de formação de ferrugem está dentro do campo da corrosão, um problema de grande impacto nas economias dos países industrializados e desenvolvidos.
Estima-se que cerca de 30% da produção mundial de ferro e aço seja perdida com a corrosão, um custo que pode corresponder de 1 a 5% do PIB dos países. Em 2019, por exemplo, o Brasil gastou na faixa de R$ 290 bilhões (cerca de 4% do seu PIB) com manutenção da corrosão.
Os custos com a manutenção de estruturas se fazem necessários, já que a reposição pode ser mais cara, e, além disso, a ferrugem traz sérios danos para a segurança estrutural. Ao oxidar, o metal perde suas boas propriedades mecânicas. Os óxidos formados, em geral, são quebradiços e podem comprometer peças, estruturas e equipamentos. Não só isso, podem também contaminar o produto acondicionado, se este, por exemplo, for um alimento.

Além dos custos diretos com a substituição e manutenção das peças enferrujadas, a ferrugem pode trazer também problemas indiretos. Uma estrutura como uma ponte ou um viaduto, que precisa ser fechada para manutenção, pode ocasionar grandes transtornos no deslocamento das pessoas, afetando comunidades e a rotina de trabalho. Maquinários enferrujados podem ter perda de eficiência ou podem ser retirados da linha de produção para manutenção, diminuindo assim a produtividade.
Como evitar a ferrugem?
Atualmente já existem técnicas antioxidativas ou anticorrosivas que diminuem drasticamente a formação da ferrugem nas peças metálicas. Entre elas, podemos destacar algumas, como proteção catódica e anódica, revestimentos anticorrosivos e inibidores de corrosão.

Na proteção catódica, o metal de interesse é protegido por um metal de mais fácil oxidação (menor potencial de redução) inserido em sua estrutura, o que dá origem a uma célula galvânica. Dessa forma, o metal inserido atua como ânodo, oxida-se, e então protege a estrutura metálica de interesse, que atua como cátodo e se mantém em sua forma reduzida (metálica). O ânodo inserido é comumente conhecido, nessa técnica, como “metal de sacrifício”, justamente por se oxidar no lugar de outro.
A utilização de revestimentos impede que a estrutura metálica entre em contato com o meio oxidativo, criando assim uma barreira que vai dificultar ou até mesmo impedir a formação da ferrugem. Um exemplo são as tintas de epóxido e o zarcão, que protegem tubulações, grades, portões, entre outros itens. Outro revestimento conhecido é a galvanização, que consiste em revestir a peça de ferro com um metal menos nobre. É o caso dos parafusos zincados, em que a estrutura de ferro é revestida pelo metal zinco.

Já os inibidores de corrosão são substâncias químicas, de natureza orgânica ou inorgânica, que são adicionadas ao meio com a finalidade de impedir o processo de formação de ferrugem. A ideia é gerar produtos no meio que formem películas protetoras e que atuem como barreira ao metal, dificultando o contato do meio oxidante.
Qual a diferença entre ferrugem e corrosão?
A ferrugem é, na verdade, a substância formada durante o processo de corrosão do ferro e de suas ligas, como o aço. A corrosão é mais ampla, pois diz respeito a todos os processos de destruição espontânea de metais e ligas, causados por interações químicas, bioquímicas e eletroquímicas entre os metais e as ligas com o meio ambiente. Durante a corrosão, os metais são convertidos em compostos termodinamicamente mais estáveis, como óxidos, hidróxidos, sais ou carbonatos. Assim sendo, podemos dizer que a formação da ferrugem é um dos processos da corrosão.
Alguns autores dizem que a ferrugem é consequência do processo de corrosão úmida ou corrosão eletroquímica, visto que tal processo necessita da presença de água para ocorrer e acontece espontaneamente.
Fontes
AZ RUST. What is Rust & The Most Common Types of Rust. AZ Rust, c2023. Disponível em: https://azrust.com/what-is-rust/.
CARNEIRO, C. Gastos para conter corrosão do aço impactam 4% do PIB brasileiro. SEGS, 2022. Disponível em: https://www.segs.com.br/mais/economia/338194-gastos-para-conter-corrosao-do-aco-impactam-4-do-pib-brasileiro.
CURTISS-WRIGHT SURFACE TECHNOLOGIES. Types of rusting and how metal surface treatment can help prevent oxidation. Curtiss-Wright Surface Technologies, 2020. Disponível em: https://www.cwst.co.uk/types-of-rusting-and-how-metal-surface-treatment-can-help-prevent-oxidation/.
MERCIER, J. P.; ZAMBELLI, G.; KURZ, W. Corrosion, degradation and ageing. In: Introduction to Materials Science, p. 379-399, 2002.
MERÇON, F.; GUIMARÃES, P. I. C.; MAINIER, F. B. Corrosão: Um Exemplo Usual de Fenômeno Químico. Química Nova Na Escola. n. 19, 2004. Disponível em: http://qnesc.sbq.org.br/online/qnesc19/a04.pdf.
POPOV, B. N. Corrosion Engineering: Principles and Solved Problems. Oxford: Elsevier, 2015.
SILVA, M. V. F.; PEREIRA, M. C.; CODARO, E. N.; ACCIARI, H. A. Corrosão do aço-carbono: uma abordagem do cotidiano no ensino de química. Química Nova, v. 38, n. 2, p. 293-296, 2015. Disponível em: https://s3.sa-east-1.amazonaws.com/static.sites.sbq.org.br/quimicanova.sbq.org.br/pdf/v38n2a22.pdf.
Por Stéfano Araújo Novais
Professor de Química

