Saber como calcular o NOX é importante dentro da Química, principalmente para avaliação de reações de oxirredução. O NOX é a carga que o elemento adquire ao estabelecer uma ligação química. No caso de compostos iônicos, o NOX é numericamente igual à carga de cada componente, enquanto, nos compostos covalentes, prevalecerão comparações de eletronegatividade.
Calcular o NOX pode ser mais fácil se nos atentarmos a algumas regras. Uma delas afirma que elementos em substâncias simples têm NOX igual a zero, assim como o somatório das cargas dos elementos em um composto é igual à carga total do composto. Outro facilitador no cálculo do NOX é a tabela de NOX, pois alguns elementos, independentemente do ambiente químico, adquirem sempre a mesma carga.
Leia também: Oxirredução — processo químico em que há transferência de elétrons entre elementos
Tópicos deste artigo
- 1 - Resumo sobre NOX
- 2 - Como fazer o cálculo do NOX?
- 3 - Regras do NOX
- 4 - Tabela de NOX
- 5 - Exercícios resolvidos sobre como calcular o NOX
Resumo sobre NOX
- O NOX é a carga que o elemento adquire após estabelecer uma ligação química.
- Em compostos iônicos, o NOX do elemento é igual à sua carga, em compostos covalentes, dependerá das diferenças de eletronegatividade.
- Regras para cálculo do NOX tornam a vida do estudante mais simples, chegando-se, na maioria das vezes, mais rápido ao valor final. São elas:
- 1ª regra: o NOX de um átomo em uma substância simples é sempre igual a 0.
- 2ª regra: o NOX de uma espécie em um íon simples é igual à carga do íon.
- 3ª regra: para substâncias compostas, iônicas ou covalentes, o somatório dos valores de NOX é igual à carga total.
- A tabela de NOX também é uma ferramenta importante, uma vez que alguns elementos sempre adquirem o mesmo NOX, independentemente do ambiente químico que se encontram.
Como fazer o cálculo do NOX?
O número de oxidação (NOX) é a carga que um elemento adquire ao estabelecer uma ligação química. Assim sendo, a sua determinação dependerá única e exclusivamente das espécies que estão ligadas a ele.
Para compostos iônicos, o cálculo é simples: o NOX é numericamente igual ao número de elétrons ganhados ou perdidos por cada espécie na formação do composto. Por exemplo, no composto MgCl2, o magnésio perde os seus dois elétrons de valência, uma vez que sua camada de valência original é 3s2. Já cada átomo de cloro deve ganhar um elétron na formação desse composto, pois a sua camada de valência original é 3s2 3p5. Por isso, o NOX do Mg nesse composto é igual a +2, enquanto de cada átomo de cloro é igual a -1.
[publicidade _omnia]
Já em compostos covalentes, em que não há perda e ganho de elétrons (afinal, não há ionização), a avaliação do NOX se dá por meio da eletronegatividade. Vejamos no exemplo a seguir.
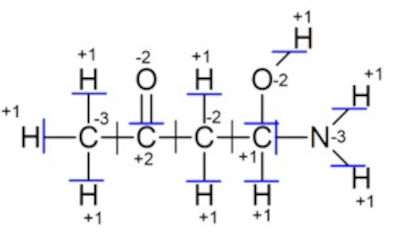
Cada ligação covalente é feita pelo compartilhamento de dois elétrons. A eletronegatividade é a capacidade do átomo em atrair os elétrons da ligação. Sendo assim, a espécie mais eletronegativa traz para próximo de si os dois elétrons da ligação covalente: o seu, mais o da outra espécie.
No caso acima, a espécie mais eletronegativa é o oxigênio, seguido por nitrogênio, carbono e hidrogênio. Por isso, nas ligações C−H, como o carbono é mais eletronegativo, ambos os elétrons da ligação covalente ficam próximo a ele, ou seja, o seu elétron (sua parte da contribuição) mais o elétron do hidrogênio. Como o carbono “ganhou” um elétron a mais, a sua carga decaiu -1, enquanto o hidrogênio ficou com carga +1.
Isso nos faz entender o começo da molécula, em que o carbono se liga a três átomos de hidrogênio, ou seja, ele “ganha” os três elétrons de cada hidrogênio, ficando com uma carga total igual a -3, enquanto cada hidrogênio fica com um NOX igual a +1.
Entre carbonos não há diferença de eletronegatividade, portanto, os elétrons ficam homogeneamente distribuídos, não havendo contribuição para o NOX. Na imagem utilizada, a barra azul mostra que os elétrons da ligação covalente estão todos para o lado do átomo mais eletronegativo, enquanto a barra preta é utilizada para quando as espécies têm a mesma eletronegatividade.
Na ligação C=O, quatro elétrons estão envolvidos: dois do carbono mais dois do oxigênio. Como o oxigênio é mais eletronegativo que o carbono, os dois elétrons do carbono irão se aproximar mais do oxigênio, fazendo com que o NOX do oxigênio seja igual a -2, enquanto o carbono fica com a carga +2.
O carbono seguinte tem NOX igual a -2, pois está ligado a dois átomos de hidrogênio, ou seja, aproxima os elétrons desses átomos de hidrogênio, ao passo que está ligado a dois outros átomos de carbono, que nada contribuem para o NOX final, uma vez que têm a mesma eletronegatividade.
Por fim, o nitrogênio é mais eletronegativo que os três átomos ao qual ele está ligado (dois hidrogênios e um carbono), assim “ganhando” mais três elétrons e fazendo seu NOX ser igual a -3. O carbono fica com NOX igual a +1, pois ele “perde” um elétron para o nitrogênio, outro elétron para o oxigênio, mas “ganha” um elétron do átomo de hidrogênio.
Leia também: Ligações químicas — como ocorrem e tipos
Regras do NOX
Embora o cálculo do NOX varie entre espécies iônicas e covalentes, algumas regras são muito empregadas para facilitar o cálculo do número de oxidação. Tais regras agilizam a determinação das cargas e são, assim sendo, muito úteis.
- 1ª regra: o NOX de um átomo em uma substância simples é sempre igual a 0. Em uma substância simples, apenas um único elemento químico é utilizado. Dessa forma, não há diferença de eletronegatividade entre as espécies e, portanto, um átomo não altera a carga do outro. Por isso, por exemplo, em F2, o NOX do flúor é igual a 0.
- 2ª regra: o NOX de uma espécie em um íon simples é igual à carga do íon. Íons são espécies carregadas, ou seja, não são eletricamente neutras, e, por isso, não faz sentido falar em NOX igual a 0. Por exemplo, no cátion Ca2+, o NOX do cálcio é igual a +2.
- 3ª regra: para substâncias compostas, iônicas ou covalentes, o somatório dos valores de NOX é igual à carga total. Se tomamos como exemplo a espécie MgCl2, eletricamente neutra, podemos afirmar que:
NOX (Mg) + 2 . NOX (Cl) = 0
De fato, percebemos que o magnésio, ao perder dois elétrons, adquire NOX igual a +2, enquanto cada átomo de cloro, ao ganhar um elétron, adquire NOX igual a -1, por isso:
+2 + 2(-1) = 2 – 2 = 0.
Íons compostos não são eletricamente neutros. Por exemplo, no caso do íon Cr2O72−, o somatório dos valores de NOX não seria igual a 0, mas sim igual a -2, pois esta é a carga total.
Tabela de NOX
Um instrumento que facilita a determinação do NOX das espécies é a tabela de NOX. Essa tabela foi construída pelo fato de alguns elementos, ao se ligarem, adquirirem sempre a mesma carga, são os chamados elementos de NOX fixo.
São eles:
|
Elementos |
NOX |
|
Metais alcalinos (Li, Na, K, Rb, Cs e Fr) |
+1 |
|
Metais alcalino-terrosos (Be, Mg, Ca, Sr, Ba e Ra) |
+2 |
|
Flúor (F) |
-1 |
|
Alumínio (Al) |
+3 |
|
Zinco (Zn) |
+2 |
|
Cádmio (Cd) |
+2 |
|
Prata (Ag) |
+1 |
Outros elementos quase sempre obtêm a mesma carga, dependendo apenas do ambiente químico em que estão inseridos. É o caso do oxigênio, que, na maioria das vezes, apresentará NOX igual a -2, com algumas exceções, assim como hidrogênio, enxofre e halogênios. Os casos estão expostos a seguir.
|
Elementos |
Caso |
NOX |
|
Oxigênio (O) |
Em geral |
-2 |
|
Com o flúor |
+1 (O2F2) e +2 (OF2) |
|
|
Peróxidos |
-1 |
|
|
Superóxidos |
-½ |
|
|
Hidrogênio (H) |
Em geral |
+1 |
|
Em hidretos |
-1 |
|
|
Halogênios (Cl, Br e I) |
Sendo a espécie mais eletronegativa |
-1 |
|
Enxofre (S) |
Sendo a espécie mais eletronegativa |
-2 |
A aplicação da tabela de NOX auxilia bastante no cálculo do NOX de uma espécie desconhecida. Por exemplo, como calcular o NOX do enxofre no H2SO4? Em vez de abrirmos a fórmula estrutural e avaliar a eletronegatividade dos participantes, podemos usar a tabela de NOX e a regra que diz que o somatório das cargas das espécies participantes é igual à carga total do composto que, neste caso, é igual a 0.
Assim:
2.NOX(H) + NOX(S) + 4.NOX(O) = 0
2(+1) + NOX(S) + 4(−2) = 0
+2 + NOX(S) – 8 = 0
NOX(S) = +6
Exercícios resolvidos sobre como calcular o NOX
Questão 1. (Uerj/2024.2) Recentemente, a Marinha do Brasil afundou no mar um porta aviões deteriorado. Ambientalistas criticaram a operação, pois a estrutura do navio continha amianto, fibra mineral nociva à saúde. O principal componente do amianto é a substância de fórmula química Mg3Si2O5(OH)4.
Nessa substância, o número de oxidação do silício é igual a:
A) -6
B) -4
C) +4
D) +6
Resposta: Letra C.
O NOX do silício, nesse caso, pode ser calculado se aproveitando da regra que diz que o somatório das cargas de um composto é igual a sua carga total, que, neste caso, é igual a 0. O magnésio é um metal alcalino-terroso, e, nesta situação, a carga do oxigênio é igual a -2 e do hidrogênio é igual a +1.
3.NOX(Mg) + 2.NOX(Si) + 5.NOX(O) + 4.(NOX(O) + NOX(H)) = 0
3(+2) + 2.NOX(Si) + 5(−2) + 4(−2+1) = 0
+6 + 2.NOX(Si) – 10 + 4(−1) = 0
2.NOX(Si) – 4 – 4 = 0
2.NOX(Si) = +8
NOX(Si) = +4
Questão 2. (FMP Medicina/2024) A água oxigenada corresponde a uma solução aquosa de peróxido de hidrogênio (H2O2). As propriedades antissépticas e desinfetantes do H2O2 decorrem de seu elevado poder oxidante. Na equação química a seguir, é representada a reação do peróxido de hidrogênio com sulfeto de sódio.
Na2S + 4 H2O2 → Na2SO4 + 4 H2O
Nessa equação, observa-se a seguinte alteração do número de oxidação do enxofre:
A) de -1 para +4.
B) de -1 para +6.
C) de -2 para +4.
D) de -2 para +6.
Resposta: Letra D.
O enxofre inicia ao lado do sódio, no Na2S. Pela tabela de NOX, pode-se afirmar que o NOX do enxofre neste caso é igual a -2, uma vez que é a espécie mais eletronegativa, mas também é possível chegar a essa conclusão fazendo-se a conta:
2.NOX(Na) + NOX(S) = 0
Como sódio é metal alcalino:
2(+1) + NOX(S) = 0
NOX(S) = -2
Para o Na2SO4, devemos seguir a seguinte conta:
2.NOX(Na) + NOX(S) + 4.NOX(O) = 0
Neste caso, o NOX do oxigênio é igual a -2.
2(+1) + NOX(S) + 4(−2) = 0
+2 + NOX(S) – 8 = 0
NOX(S) = +6
Fontes:
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
INTERNATIONAL OF PURE AND APPLIED CHEMISTRY – IUPAC. Compendium of Chemical Terminology – IUPAC Recommendations (Gold Book). Disponível em: < https://goldbook.iupac.org/>. Acesso em 31 ago. 2024.
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.