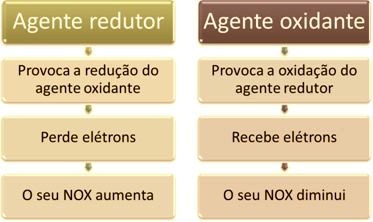
Uma das características principais que distinguem uma reação de oxirredução (ou redox) das demais é a presença de um agente oxidante e de um agente redutor, que podem ser definidos da seguinte maneira:
Por exemplo, observe a reação química abaixo em que há a corrosão do alumínio (Al) em solução aquosa de ácido clorídrico (HCl). Os átomos de alumínio transferem elétrons para os cátions H+(aq) e produzem o cátion Al3+(aq):
.jpg)
Note que como o Al transferiu elétrons, isso significa que ele causou a redução dos cátions H+(aq); por isso ele é chamado de agente redutor. Já o cátion H+(aq) retirou os elétrons do alumínio, causando a oxidação desse metal; portanto ele atua como um agente oxidante.
No cotidiano existem muitos exemplos da atuação de agentes oxidantes e de agentes redutores. Veja alguns deles e, lembre-se, porém, de que em todos os casos a redução ocorre simultaneamente à oxidação; portanto, se há um agente redutor, também existe um agente oxidante.
- Exemplos de agentes redutores:
- Nos filmes fotográficos: os filmes fotográficos contêm sais de prata sensíveis à luz. Nos pontos em que há incidência de luz ocorre a redução de íons Ag+, resultando no contraste observado nos negativos.

- Vitamina C: a vitamina C (ácido L-ascórbico) é um agente redutor poderoso em solução aquosa. Ela possui uma excepcional facilidade para ser oxidada e por isso é muito utilizada, principalmente em alimentos como um antioxidante, ou seja, ela é adicionada a outros alimentos e protege-os de possíveis oxidações, em razão do seu próprio sacrifício. Um exemplo são frutas como a maçã e a pera que escurecem em contato com o oxigênio do ar, porque elas oxidam. Mas, quando se adiciona uma pequena quantidade de suco de laranja ou de limão (que contêm vitamina C) na fruta cortada, isso evita que essa reação ocorra, porque a vitamina C age como agente redutor e oxida antes da fruta.

- Gás hidrogênio: o gás hidrogênio (H2) é usado na propulsão de foguetes e é considerado uma das mais importantes alternativas energéticas, pois a sua combustão libera uma grande quantidade de energia e nenhum poluente. Nessa reação, o hidrogênio atua como agente redutor, sendo oxidado pelo oxigênio.
- Exemplos de agentes oxidantes:
- Na produção do vinagre: quando o vinho é exposto ao ar, ele se transforma em vinagre, cujo principal componente é o ácido acético. Isso ocorre porque o álcool etílico ou etanol presente no vinho oxida-se em contato com o oxigênio atmosférico, resultando no ácido acético. Assim, o oxigênio é um agente oxidante. Inclusive a origem do termo “oxidação” está relacionada à reação com o oxigênio.

- Na ferrugem: conforme dito no exemplo anterior, o oxigênio atua como um agente oxidante do álcool; e ele faz isso também em contato com vários metais, como o ferro, causando o processo de ferrugem. Além do oxigênio do ar, outros agentes oxidantes nesse caso são a água ou uma solução ácida.
- Nos alvejantes: o efeito branqueador dos alvejantes se dá em razão da presença dos dois agentes redutores a seguir: o ânion hipoclorito (em geral, na forma de sal sódico – NaOCl), presente, por exemplo, na água sanitária; e o peróxido de hidrogênio (H2O2), comercializado como água oxigenada. Esses dois compostos apresentam uma tendência muito grande de se oxidarem e causarem a redução de outras espécies químicas. Portanto, eles são responsáveis por oxidar as substâncias que conferem cor escura aos produtos. Por exemplo, na celulose, a lignina é quebrada e se torna mais clara e maleável. No caso de remoção de manchas e clareamento de tecidos, esses agentes oxidantes causam a oxidação de moléculas orgânicas, como gorduras e corantes.

- Nos bafômetros: um bafômetro simples descartável consiste em um tubo transparente contendo uma solução aquosa do sal dicromato de potássio e sílica, umedecida com ácido sulfúrico; misturada com cor laranja. Esse sal, em contato com o vapor do álcool contido na respiração do motorista embriagado, reage, mudando a coloração para verde. Isso significa que é causada a oxidação do etanol (álcool) à etanal.
.jpg)
Por Jennifer Fogaça
Graduada em Química



