As reações de oxirredução estudadas principalmente em Físico-Química são aquelas em que ocorre transferência de elétrons. A espécie reagente (átomo, íon ou molécula) que perde um ou mais elétrons é a que sofre oxidação. Já a espécie química que recebe elétrons sofre redução.
Geralmente, quando esse tipo de reação é estudado em Química Inorgânica, ele é chamado de reação de simples troca ou de deslocamento.
Para que qualquer reação ocorra é necessário satisfazer determinadas condições. Uma delas é que deve haver afinidade química entre os reagentes, isto é, eles devem interagir de modo a possibilitar a formação de novas substâncias.
No caso das reações de oxirredução, a afinidade quer dizer que um dos reagentes tem a tendência de ganhar elétrons e o outro tende a perder elétrons. Essa tendência corresponde à reatividade dos elementos químicos envolvidos.
Vamos ver como é possível comparar a reatividade entre os metais.
Considere que desejamos armazenar uma solução de sulfato de cobre II (CuSO4). Nós não poderíamos de forma alguma colocar essa solução num recipiente de alumínio, porque ocorreria a seguinte reação:
2 Al(s) + 3 CuSO4(aq)→ 3 Cu(s) + Al2(SO4)3(aq)
Observe que o alumínio se oxidou, perdendo 3 elétrons cada e se tornando cátion alumínio:
Al(s) → Al3+(aq) + 3 e-
Simultaneamente, o cátion cobre (Cu2+) que estava presente na solução recebeu os elétrons do alumínio e se reduziu, tornando-se cobre metálico. Cada cátion cobre recebe dois elétrons:
Cu2+(aq) + 2 e- → Cu(s)
No entanto, se fosse o contrário e quiséssemos armazenar uma solução de sulfato de alumínio (Al2(SO4)3(aq)), não teria problema nenhum colocá-la num recipiente de cobre, pois esta reação não iria ocorrer:
Cu(s) + Al2(SO4)3(aq) → não ocorre
Esses fatos observados podem ser explicados pelo fato de o alumínio ser mais reativo que o cobre.
Os metais têm a tendência de ceder elétrons, isto é, de se oxidar. Quando comparamos vários metais, o que possui maior tendência de doar elétrons é o mais reativo. Consequentemente, a reatividade dos metais está associada também à sua energia de ionização, isto é, a energia mínima necessária para remover um elétron do átomo gasoso em seu estado fundamental.

Com base nisso, surgiu a fila de reatividade dos metais ou fila das tensões eletrolíticas, mostrada abaixo:
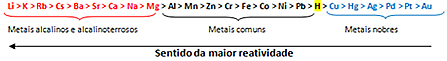
O metal mais reativo reage com substâncias iônicas cujos cátions são menos reativos. Em outras palavras, o metal à esquerda reage com a substância formada por íons situados à sua direita. O contrário não ocorre.
Lembrando-se do exemplo que foi dado, veja na fila de reatividade que o alumínio (Al) está à esquerda do cobre (Cu). Por isso, o alumínio reage com a solução formada pelos cátions do cobre; mas o cobre não reage com uma solução formada por cátions alumínio.
Veja que o metal mais reativo é o lítio (Li) e o menos reativo é o ouro (Au).

Esse é um dos motivos do ouro ser tão valioso, pois não reagindo, ele permanece intacto por muito tempo. Isso pode ser visto nos sarcófagos e esculturas egípcias revestidas de ouro que datam desde a mais remota antiguidade. Também visualizamos isso quando comparamos a durabilidade de uma joia de ouro puro com a de joias feitas de outros metais que são mais reativos que o ouro.

Por Jennifer Fogaça
Graduada em Química


