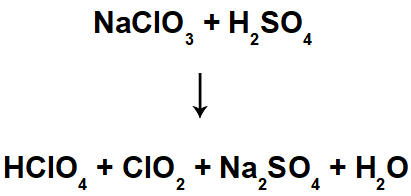
A reação de auto-oxirredução ou desproporcionamento é um tipo de reação de oxirredução em que um mesmo elemento químico sofre oxidação e redução. Vejamos dois exemplos desse tipo de reação e como balanceá-las pelo método de oxirredução:
1º Exemplo:
NO2- + H+ → NO3- + NO + H2O
- Calculando os números de oxidação (NOX) de todos os átomos e íons envolvidos na reação, é possível verificar quem oxidou e quem reagiu:
+3 -2 +1 +5 -2 +2 -2 +1 -2
NO2- + H+ → NO3- + NO + H2O
- Observe que o nitrogênio foi a espécie que tanto reagiu como oxidou:
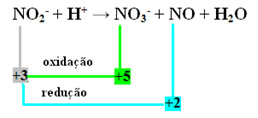
- Para realizar o balanceamento por oxirredução dessa reação, temos que relacionar o NOX com os produtos, e não com os reagentes:
NO3- =∆Nox = 5 - 3 = 2
NO=∆Nox = 3 - 2 = 1
- Invertendo os ∆NOX pelos coeficientes, temos:
NO3- =∆NOX= 2 → 2 será o coeficiente de NO
NO=∆NOX= 1→ 1 será o coeficiente de NO3-
NO2- + H+ → 1 NO3- + 2 NO + H2O
- Com isso, já sabemos que existem 3 N no produto, portanto o coeficiente de NO2- será 3:
3 NO2- + H+ → 1 NO3- + 2 NO + H2O
- Para determinar os coeficientes de H+ e de H2O, lembre-se de que o número de elétrons recebidos equivale à mesma quantidade de elétrons doados; assim, a carga do reagente será igual à carga do produto. Desse modo, podemos fazer o seguinte esquema:
.jpg)
Com base nessas informações, temos que a carga total dos reagentes é igual a x – 3 e a dos produtos é igual a -1. Conforme dito, as cargas dos dois têm que ser iguais. Como já temos a carga total dos produtos, podemos realizar uma conta simples para saber qual será o valor de x:
x -3 = -1
x = -1 +3
x = 2
Assim, o coeficiente de H+ é 2 e, consequentemente, o de H2O será 1:
3 NO2- + 2 H+ → 1 NO3- + 2 NO + 1 H2O
2º Exemplo:
.jpg)
Nesse caso, foi o S que sofreu redução e oxidação ao mesmo tempo. Assim, como feito anteriormente, podemos relacionar o NOX com os produtos e inverter seus valores, atribuindo-lhes os coeficientes:
Na2 S=∆Nox = 4 – (-2) = 6 → 6 será o coeficiente de Na2 SO4
Na2 SO4=∆Nox = 6 - 4 = 2 → 2 será o coeficiente de Na2 S
Na2 SO3→ 2 Na2 S + 6 Na2 SO4
Visto que existem 8 enxofres no 2º membro, o coeficiente de Na2 SO3 será 8:
8 Na2 SO3→ 2 Na2 S + 6 Na2 SO4
Por Jennifer Fogaça
Graduada em Química