Os ametais são elementos que possuem a tendência de ganhar elétrons e formar ânions (espécies carregadas negativamente). Isso significa que eles possuem alta eletronegatividade, ou elevada tendência para atrair os elétrons. Dizemos que quanto mais eletronegativo o ametal for, mais reativo ele será.
Experimentalmente foi possível determinar a ordem de reatividade dos ametais, que é dada pelo seguinte:
F > O > N > Cℓ > Br > I > S > C > P > H
Veja os valores das eletronegatividades, respectivamente:
4,0 > 3,5 > 3,0 > 3,0 > 2,8 > 2,5 > 2,5 > 2,5 < 2,1
Existe uma espécie de “macete” para decorar essa fila de eletronegatividade dos ametais, que é dada pela frase abaixo, em que a inicial de cada palavra corresponde ao símbolo dos elementos em questão:
“Fui Ontem No Clube, Briguei I Saí Correndo Para o Hospital”
Mas por que precisamos conhecer a reatividade dos ametais? Um dos motivos é para determinar se a reação química ocorrerá ou não.
As reações de simples troca ou deslocamento são aquelas em que uma substância simples (formada somente por um tipo de elemento químico) reage com uma substância composta e desloca um dos elementos dessa substância, formando uma nova substância simples e outra composta. Genericamente, temos:
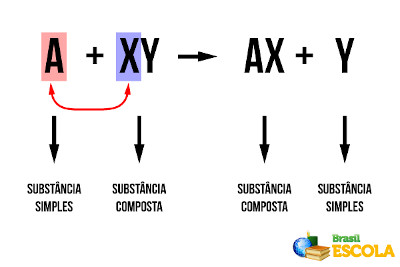
Reação genérica de deslocamento
Veja que “A” deslocou o “Y” e uniu-se ao “X”. Essa também é uma reação de oxirredução, pois há transferência de elétrons. Considerando que “A” e “Y” são ametais, temos que “A” ganha elétrons (sofre redução), formando um ânion, e faz parte da substância composta “AX”. Por outro lado, o “Y”, que era um ânion na substância composta “XY”, perdeu elétrons (sofreu oxidação) e formou a nova substância simples “Y”.
Quando esse tipo de reação ocorre, é preciso analisar a reatividade dos ametais para ver se o elemento da substância simples terá realmente a reatividade necessária para deslocar o ametal da substância composta. Considere, por exemplo, a reação entre o flúor e o cloreto de sódio:
F2(aq) + 2 NaCl(aq) → ?
Será que o flúor (F2) consegue deslocar o cloro do cloreto de sódio (NaCl) e formar uma nova substância composta com o sódio? Na fila de reatividade dos ametais, o flúor é mais reativo que o cloro. Então ele consegue sim deslocar o cloro do NaCl, e a reação ocorre da seguinte forma:
F2(aq) + 2 NaCl(aq) → 2 NaF(aq) + Cl2(aq)
Visto que é mais eletronegativo, o F2(aq) reduziu-se, e cada átomo de flúor ganhou um elétron, formando o ânion F-(aq). Esse ânion forma uma ligação iônica com o cátion Na+(aq), gerando o fluoreto de sódio (NaF). Enquanto isso, o ânion Cl-(aq), que fazia parte do cloreto de sódio (NaCl), oxidou-se e formou átomos de cloro que se uniram e originaram a substância simples Cl2.
Agora veja outro exemplo abaixo. Será que essa reação ocorrerá?
I2(aq) + KCl(aq) → ?
Se olharmos a fila de reatividade dos ametais, veremos que não ocorrerá nenhuma reação de oxirredução entre essas substâncias, pois o Cl é mais reativo que o I, portanto, o I2 não terá força necessária para deslocar o Cl da substância KCl.
Por Jennifer Fogaça
Graduada em Química

