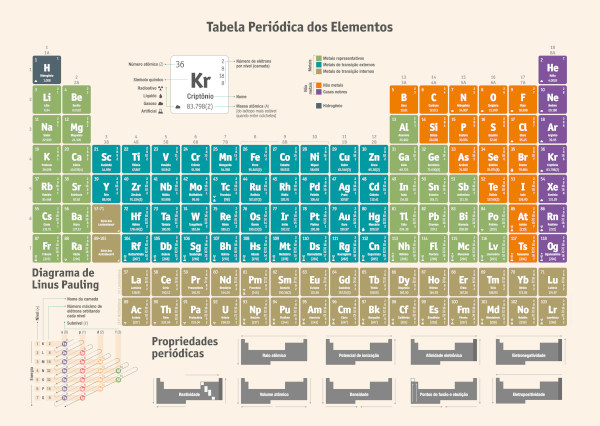
A massa atômica (ou peso atômico) é a unidade que faz referência à massa de um único átomo. Os valores de massa atômica são dimensionados pela unidade de massa atômica (u), que não pertence ao Sistema Internacional de Unidades e equivale a 1/12 de um átomo de carbono-12 no seu estado fundamental. Em quilogramas, 1 u é, aproximadamente, igual a 1,6605402 x 10−27 kg.
A massa atômica é determinada por métodos físicos, os quais garantem boa precisão. Contudo, como a maioria dos elementos possui diversos isótopos, é comum representar a massa atômica de cada elemento como sendo resultado da média ponderada das massas atômicas dos seus isótopos. Os valores de massa atômica são conferidos a cada dois anos pela Comissão sobre Abundâncias Isotópicas e Pesos Atômicos da Iupac.
Leia também: Afinal, o que são os átomos?
Tópicos deste artigo
- 1 - Resumo sobre massa atômica
- 2 - O que é massa atômica?
- 3 - Como calcular a massa atômica?
- 4 - O que a massa atômica indica?
- 5 - Massa atômica na Tabela Periódica
- 6 - Tabela de massa atômica
- 7 - Massa atômica x massa molar
- 8 - Mapa mental sobre massa atômica
- 9 - Exercícios resolvidos sobre massa atômica
Resumo sobre massa atômica
- Massa atômica (ou peso atômico) é a unidade que se refere à massa de um único átomo.
- É expressa em unidade de massa atômica (u), que equivale a 1/12 do átomo de carbono-12 em seu estado fundamental.
- A massa atômica dos elementos com dois ou mais isótopos estáveis é determinada pela média ponderada das massas dos isótopos.
- Elementos radioativos, que não possuem isótopos estáveis, não possuem massa atômica determinada, contudo é comum utilizar o número de massa para eles.
- As massas atômicas podem ser consultadas na Tabela Periódica.
- As massas atômicas são controladas pela Comissão sobre Abundâncias Isotópicas e Pesos Atômicos da Iupac.
- As massas atômicas são numericamente iguais às massas molares.
O que é massa atômica?
A massa atômica (ou peso atômico) é a unidade que faz referência à massa de um átomo, cujos valores são dimensionados pela unidade de massa atômica (u, embora alguns autores optem por u.m.a), não pertencente ao Sistema Internacional (SI). 1 u equivale a 1/12 de um átomo de carbono-12 em seu estado fundamental e é aproximadamente igual a 1,6605402 x 10−27 kg.
Como calcular a massa atômica?
As massas atômicas de átomos isolados são determinadas por métodos físicos, os quais possuem a vantagem de maior precisão, como é o caso da espectrometria de massas. Contudo, um mesmo elemento pode ter diversos isótopos, ou seja, átomos que possuem o mesmo número de prótons, mas um número de nêutrons diferentes e, por conta disso, apresentam uma massa atômica diferente.
Para elementos que possuem dois ou mais isótopos, a União Internacional de Química Pura e Aplicada (Iupac), por meio da sua Comissão sobre Abundâncias Isotópicas e Pesos Atômicos (do inglês, Commission on Isotopic Abundances and Atomic Weights, CIAAW), recomenda que a massa atômica para um determinado elemento seja a média ponderada das massas dos seus respectivos isótopos relativamente estáveis, em que o peso aplicado na média é a abundância isotópica. Tais valores são revistos a cada dois anos pela Iupac.
O cloro, por exemplo, apresenta dois isótopos: cloro-35 e cloro-37. O cloro-35 apresenta uma abundância isotópica média de 75,8% e uma massa atômica de 34,969 u aproximadamente, enquanto o cloro-37 apresenta uma abundância isotópica média de 24,2% e uma massa atômica de 36,966 u, aproximadamente.
Assim, a massa atômica para o cloro pode ser determinada da seguinte forma:
\(MA_\text{Cl} = \frac{(34{,}969 \cdot 75{,}8) + (36{,}966 \cdot 24{,}2)}{100} \cong 35{,}452\ \text{u} \)
Dos elementos que existem na Tabela Periódica, 19 possuem apenas um único isótopo: berílio (Be), flúor (F), sódio (Na), alumínio (Al), fósforo (P), escândio (Sc), manganês (Mn), cobalto (Co), arsênio (As), ítrio (Y), nióbio (Nb), ródio (Rh), iodo (I), césio (Cs), praseodímio (Pr), térbio (Tb), hólmio (Ho), túlio (Tm) e ouro (Au). Assim sendo, a massa atômica padrão é exatamente igual à massa atômica do isótopo desses elementos.
Veja também: Número atômico — a quantidade de prótons contidos no núcleo de um átomo
O que a massa atômica indica?
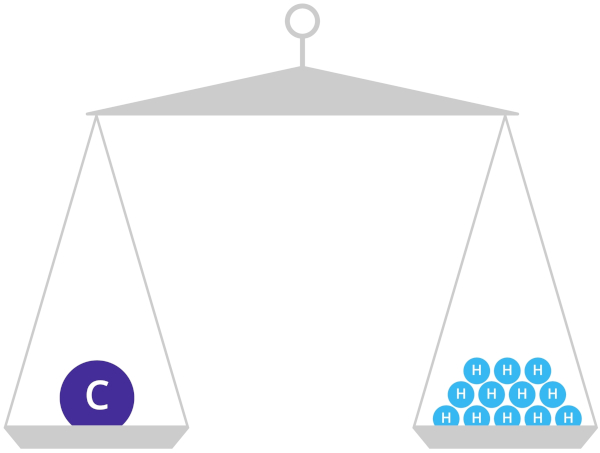
A massa atômica apresenta a massa de um átomo, em uma unidade específica, conhecida como unidade de massa atômica (u). A unidade de massa atômica corresponde a 1/12 do átomo de carbono-12 no estado fundamental, ou seja, se um átomo apresenta uma massa de 10 u, isso significa que ele possui uma massa 10 vezes maior que 1/12 do átomo de carbono-12 no estado fundamental.
Massa atômica na Tabela Periódica
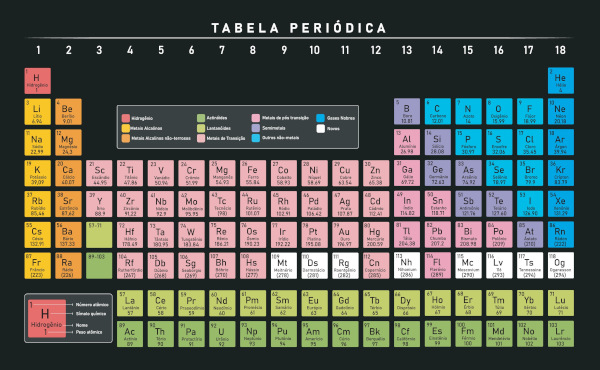
A massa atômica pode ser indicada na Tabela Periódica, sendo que os valores lá presentes são resultados das médias ponderadas das massas atômicas dos isótopos estáveis dos elementos. Inicialmente, Dmitri Mendeleev, criador da Tabela Periódica, utilizou a massa atômica para organizar os elementos nessa tabela, colocando-os em ordem crescente de massa. Contudo, os trabalhos de Henry Moseley, em 1913, alteraram a organização dos elementos, colocando-os em ordem crescente de números atômicos.
Contudo, para se ter certeza do valor de massa atômica de cada elemento, deve-se buscar a legenda da Tabela Periódica que se está consultando, pois a Iupac não regulamenta a quantidade e a disposição dos dados dentro dos quadrados dos elementos da Tabela.
Elementos radioativos não possuem uma massa atômica padrão. Porém, muitas versões de Tabela Periódica colocam o número de massa do isótopo mais estável desses elementos, porém, em geral, com valores entre parênteses, para indicação de que não se trata de uma massa atômica padrão. É o caso dos elementos mais novos, como o oganessônio (Og), cuja massa indicada é 294, em referência ao isótopo 294Og, que possui meia-vida de 0,7 milissegundos.
Vale lembrar que o número de massa (em geral representado pela letra A) não é igual à massa atômica, pois o número de massa é obtido pela simples adição do número de prótons e nêutrons presentes no núcleo da espécie. Contudo, prótons e nêutrons possuem massas diferentes. A massa do próton, em unidade de massa atômica, é igual a 1,0073 u, enquanto a do nêutron é de 1,0087 u.
Tabela de massa atômica
A seguir estão dispostos as massas atômicas dos elementos aproximadas com duas casas decimais. Para os elementos radioativos, marcados com asterisco (*), será colocada a massa referente ao isótopo mais estável.
|
Elemento |
Número atômico |
Massa atômica aproximada |
|
Hidrogênio, H |
1 |
1,01 |
|
Hélio, He |
2 |
4,00 |
|
Lítio, Li |
3 |
6,97 |
|
Berílio, Be |
4 |
9,01 |
|
Boro, B |
5 |
10,81 |
|
Carbono, C |
6 |
12,01 |
|
Nitrogênio, N |
7 |
14,01 |
|
Oxigênio, O |
8 |
16,00 |
|
Flúor, F |
9 |
19,00 |
|
Neônio, Ne |
10 |
20,18 |
|
Sódio, Na |
11 |
22,99 |
|
Magnésio, Mg |
12 |
24,31 |
|
Alumínio, Al |
13 |
26,98 |
|
Silício, Si |
14 |
28,08 |
|
Fósforo, P |
15 |
30,97 |
|
Enxofre, S |
16 |
32,07 |
|
Cloro, Cl |
17 |
35,45 |
|
Argônio, Ar |
18 |
39,88 |
|
Potássio, K |
19 |
39,10 |
|
Cálcio, Ca |
20 |
40,01 |
|
Escândio, Sc |
21 |
44,95 |
|
Titânio, Ti |
22 |
47,88 |
|
Vanádio, V |
23 |
50,94 |
|
Cromo, Cr |
24 |
52,00 |
|
Manganês, Mn |
25 |
54,94 |
|
Ferro, Fe |
26 |
55,84 |
|
Cobalto, Co |
27 |
58,93 |
|
Níquel, Ni |
28 |
58,69 |
|
Cobre, Cu |
29 |
63,55 |
|
Zinco, Zn |
30 |
65,38 |
|
Gálio, Ga |
31 |
69,72 |
|
Germânio, Ge |
32 |
72,63 |
|
Arsênio, As |
33 |
74,92 |
|
Selênio, Se |
34 |
78,97 |
|
Bromo, Br |
35 |
79,90 |
|
Criptônio, Kr |
36 |
83,80 |
|
Rubídio, Rb |
37 |
85,47 |
|
Estrôncio, Sr |
38 |
87,62 |
|
Ítrio, Y |
39 |
88,91 |
|
Zircônio, Zr |
40 |
91,22 |
|
Nióbio, Nb |
41 |
92,91 |
|
Molibdênio, Mo |
42 |
95,95 |
|
Tecnécio, Tc * |
43 |
97,91 |
|
Rutênio, Ru |
44 |
101,07 |
|
Ródio, Rh |
45 |
102,90 |
|
Paládio, Pd |
46 |
106,42 |
|
Prata, Ag |
47 |
107,87 |
|
Cádmio, Cd |
48 |
112,41 |
|
Índio, In |
49 |
114,82 |
|
Estanho, Sn |
50 |
118,71 |
|
Antimônio, Sb |
51 |
121,76 |
|
Telúrio, Te |
52 |
127,60 |
|
Iodo, I |
53 |
126,90 |
|
Xenônio, Xe |
54 |
131,29 |
|
Césio, Cs |
55 |
132,90 |
|
Bário, Ba |
56 |
137,33 |
|
Lantânio |
57 |
138,90 |
|
Cério, Ce |
58 |
140,12 |
|
Praseodímio, Pr |
59 |
140,91 |
|
Neodímio, Nd |
60 |
144,24 |
|
Promécio, Pm * |
61 |
144,91 |
|
Samário, Sm |
62 |
150,36 |
|
Európio, Eu |
63 |
151,96 |
|
Gadolínio, Gd |
64 |
157,25 |
|
Térbio, Tb |
65 |
158,92 |
|
Disprósio, Dy |
66 |
162,50 |
|
Hólmio, Ho |
67 |
164,93 |
|
Érbio, Er |
68 |
167,26 |
|
Túlio, Tm |
69 |
168,93 |
|
Itérbio, Yb |
70 |
173,04 |
|
Lutécio, Lu |
71 |
174,97 |
|
Háfnio, Hf |
72 |
178,49 |
|
Tântalo, Ta |
73 |
180,95 |
|
Tungstênio, W |
74 |
183,84 |
|
Rênio, Re |
75 |
186,21 |
|
Ósmio, Os |
76 |
190,23 |
|
Irídio, Ir |
77 |
192,22 |
|
Platina, Pt |
78 |
195,08 |
|
Ouro, Au |
79 |
196,97 |
|
Mercúrio, Hg |
80 |
200,59 |
|
Tálio, Tl |
81 |
204,38 |
|
Chumbo, Pb |
82 |
207,04 |
|
Bismuto, Bi |
83 |
208,98 |
|
Polônio, Po * |
84 |
208,98 |
|
Astato, At * |
85 |
209,99 |
|
Radônio, Rn * |
86 |
222,02 |
|
Frâncio, Fr * |
87 |
223,02 |
|
Rádio, Ra * |
88 |
226,02 |
|
Actínio, Ac * |
89 |
227,03 |
|
Tório, Th |
90 |
232,04 |
|
Protactínio, Pa |
91 |
231,04 |
|
Urânio, U |
92 |
238,03 |
|
Neptúnio, Np * |
93 |
237,05 |
|
Plutônio, Pu * |
94 |
244,06 |
|
Amerício, Am * |
95 |
243,06 |
|
Cúrio, Cm * |
96 |
247,07 |
|
Berquélio, Bk * |
97 |
247,07 |
|
Califórnio, Cf * |
98 |
251,08 |
|
Einstênio, Es * |
99 |
252,08 |
|
Férmio, Fm * |
100 |
257,09 |
|
Mendelévio, Md * |
101 |
258,10 |
|
Nobélio, No * |
102 |
259,10 |
|
Laurêncio, Lr * |
103 |
266,12 |
|
Rutherfórdio, Rf * |
104 |
267,12 |
|
Dúbnio, Db * |
105 |
268,12 |
|
Seabórgio, Sg * |
106 |
269,13 |
|
Bóhrio, Bh * |
107 |
270,13 |
|
Hássio, Hs * |
108 |
269,13 |
|
Meitnério, Mt * |
109 |
277,15 |
|
Darmstádtio, Ds * |
110 |
281,16 |
|
Roentgênio, Rg * |
111 |
282,17 |
|
Copernício, Cn * |
112 |
285,18 |
|
Nihônio, Nh * |
113 |
286,18 |
|
Fleróvio, Fl * |
114 |
290,19 |
|
Moscóvio, Mc * |
115 |
290,20 |
|
Livermório, Lv * |
116 |
293,20 |
|
Tenesso, Ts * |
117 |
294,21 |
|
Oganessônio, Og * |
118 |
294,21 |
Massa atômica x massa molar
Massa atômica e massa molar são numericamente iguais. Contudo, enquanto a massa atômica, expressa em u, apresenta a massa de um único átomo, a massa molar, expressa, em g/mol, a massa, em gramas, de 1 mol de entidades elementares (dentre elas, os átomos). O valor do mol é determinado pela constante de Avogadro e equivale a 6,02214076 x 1023 entidades elementares. Com isso, podemos dizer que: 1 átomo de hidrogênio possui, aproximadamente, 1 u de massa. 1 mol de átomos de hidrogênio, ou seja, 6,02214076 x 1023 átomos de hidrogênio, apresentarão uma massa aproximada de 1 grama.
Mapa mental sobre massa atômica

*Baixe o mapa mental massa atômica!
Exercícios resolvidos sobre massa atômica
Questão 1
(UFRGS) O elemento bromo apresenta massa atômica 79,9. Supondo que os isótopos 79Br e 81Br tenham massas atômicas, em unidades de massa atômica, exatamente iguais aos seus respectivos números de massa, qual será a abundância relativa de cada um dos isótopos?
A) 75% 79Br e 25% 81Br.
B) 55% 79Br e 45% 81Br.
C) 50% 79Br e 50% 81Br.
D) 45% 79Br e 55% 81Br.
E) 25% 79Br e 75% 81Br.
Resolução:
Alternativa B.
Se o isótopo 79Br possui abundância de x, então o isótopo 81Br possui abundância de 100 – x. Usando a massa atômica de 79,9, montamos a expressão:
\(79{,}9 = \frac{(79 \cdot x) + [81 \cdot (100 - x)]}{100} \)
\(7990=79x+8100-81x\)
\(2x=110\)
\(x = 55\% \)
Assim, a abundância do 79Br é 55%, enquanto do 81Br é de 45%.
Questão 2
(Ufla - PAS) Na natureza, o elemento químico Boro é encontrado em duas formas isotópicas, com 10 e 11 unidades de massa atômica. Sabendo-se que a massa atômica média do Boro é 10,811 u.m.a., a porcentagem dos dois isótopos é, respectivamente:
A) 0,811% e 99,189%.
B) 0,4762% e 52,38%.
C) 18,900% e 81,100%.
D) 10,811% e 89,189%.
Resolução:
Alternativa C.
Se o isótopo 10B possui abundância de x, então o isótopo 11B possui abundância de 100 – x. Usando a massa atômica de 10,811 u.m.a, montamos a expressão:
\(10{,}811 = \frac{(10 \cdot x) + [11 \cdot (100 - x)]}{100} \)
\(1081,1=10x+1100-11x\)
\(x = 18{,}9\% \)
Assim, a abundância do 10B é 18,9%, enquanto do 11B é de 81,1%.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
COMMISSION ON ISOTOPIC ABUNDANCES AND ATOMIC WEIGHTS. Disponível em: https://www.ciaaw.org/
INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY – IUPAC. Glossary of terms used in physical organic chemistry. Pure and Applied Chemistry, Reino Unido, 1994.
NIST STANDART REFERENCE DATABASE. CODATA Internationally recommended 2018 values of the Fundamental Physics Constants. Disponível em: https://physics.nist.gov/cuu/Constants/index.html.