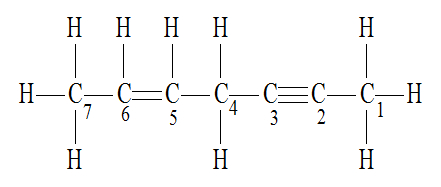
A ligação sigma (representada pela letra grega σ) é um dos dois possíveis tipos de ligações covalentes entre elementos químicos que devem receber elétrons para atingir a estabilidade eletrônica de acordo com a teoria do octeto. Podemos identificar a ligação sigma em qualquer fórmula estrutural da seguinte forma:
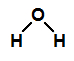
Na fórmula estrutural da água, temos a presença de duas ligações sigma
-
Ligação simples (─): é sempre uma ligação sigma;
-
Ligação dupla (=): uma ligação é sigma, e a outra é uma ligação pi;
-
Ligação tripla (≡): uma ligação é sigma, e as outras duas são ligações pi;
-
Ligação coordenada dativa (→): é sempre uma ligação sigma.
Princípios da ligação sigma
-
Sempre envolve o compartilhamento de dois elétrons entre dois átomos;
-
Ocorre quando um orbital incompleto de um átomo penetra o orbital incompleto de outro átomo em um mesmo eixo, como na representação da interpenetração de orbitais s e p a seguir:

Interpenetração de orbitais em um mesmo eixo
-
Nunca ocorre com orbitais paralelos entre si, como no caso dos orbitais p a seguir:
.jpg)
Interpenetração de orbitais p no eixo paralelo
Tipos possíveis de ligações sigma
A determinação do tipo de ligação sigma é totalmente dependente dos subníveis mais energéticos dos átomos dos elementos químicos envolvidos na ligação. Assim, é fundamental conhecer os subníveis mais energéticos.
-
Hidrogênio = seu subnível mais energético é o s;
-
Flúor, cloro, bromo, iodo, enxofre (não hibridizado, ou seja, quando estiver realizando duas ligações), oxigênio, fósforo (não hibridizado, ou seja, quando estiver realizando três ligações) e nitrogênio = apresentam o subnível p como mais energético;
-
Berílio (sempre é hibridizado) = apresenta o subnível sp mais energético;
-
Boro (sempre é hibridizado) = apresenta o subnível mais energético sp2;
-
Carbono (pode sofrer três hibridizações) = subnível mais energético sp (apenas se estiver realizando duas ligações duplas ou uma tripla e uma simples), subnível mais energético sp2 (apenas se estiver realizando duas ligações simples e uma dupla), subnível mais energético sp3 (apenas se estiver realizando ligações simples).
A partir do subnível de cada átomo envolvido, podemos determinar o tipo de ligação sigma. Vale ressaltar que o tipo da ligação sigma é escrito da seguinte maneira: primeiro, o subnível mais energético mais simples (s ou p); depois, um traço e, em seguida, o subnível mais energético mais complexo. Veja um exemplo:
.jpg)
Na fórmula estrutural da água, temos duas ligações sigma
Temos duas ligações sigma entre o hidrogênio (subnível mais energético: s) e o oxigênio (subnível mais energético: p), assim, a ligação sigma é do tipo s-p
Exemplos de determinação do tipo de ligações sigma entre átomos
→ Metanal (CH2O)
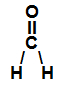
Fórmula estrutural do CH2O
No metanal, existem três ligações sigma (duas nas ligações simples e uma na ligação dupla). Duas delas ocorrem entre um átomo de hidrogênio (subnível mais energético: s) e o átomo de carbono (subnível mais energético: sp2). A terceira ocorre entre o oxigênio e o carbono. Assim, o metanal possui duas ligações sigma do tipo s-sp2 e outra do tipo p-sp2.
→ Amônia (NH3)
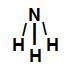
Fórmula estrutural do NH3
Na amônia, existem três ligações sigma (três ligações simples) entre um átomo de hidrogênio (subnível mais energético: s) e o átomo de nitrogênio (subnível mais energético: p). Assim, a amônia possui três ligações sigma do tipo s-p.
→ Trifluoreto de boro (BF3)
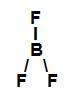
Fórmula estrutural do BF3
No trifluoreto de boro, existem três ligações sigma (três ligações simples) entre um átomo de flúor (subnível mais energético: p) e o átomo de boro (subnível mais energético: sp2). Assim, o trifluoreto de boro possui três ligações sigma do tipo p-sp2.
Por Me. Diogo Lopes Dias