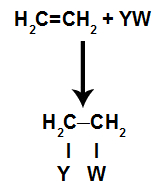
Nas reações de adição em alcenos (hidrocarbonetos que apresentam uma ligação dupla entre dois átomos de carbono), uma ligação pi entre dois carbonos é rompida e cada um dos carbonos liga-se a um novo átomo. Veja:
Modelo esquemático geral de uma reação de adição
Princípios de uma reação de adição
a) Rompimento da ligação pi
Uma ligação pi é rompida facilmente porque ela é uma ligação mais fraca do que a ligação sigma. Porém, para que isso aconteça, é necessário que o alceno seja submetido a condições que propiciem esse rompimento. Após o rompimento da ligação pi entre dois carbonos, sempre surge um sítio de ligação (para novos átomos) em cada um dos carbonos envolvidos.
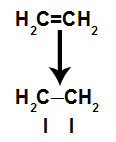
Esquema representando o rompimento da ligação pi
b) Condições para rompimento de uma ligação pi
Os fatores que favorecem o rompimento de uma ligação pi são:
-
Uso de catalisadores;
-
Aquecimento;
-
Presença de um ácido no meio reacional.
c) A ocorrência da reação de adição
Os sítios de ligação criados após o rompimento da ligação pi serão sempre ocupados por átomos do reagente que está no mesmo recipiente que o alceno. A reação de adição é nomeada a partir do tipo de reagente misturado ao alceno.
Tipos de reações de adição em alcenos
a) Hidrogenação
Um alceno é misturado com o gás hidrogênio (H2) em um recipiente e submetido a ação de um catalisador (níquel, platina ou paládio) sólido e a aquecimento (Δ).
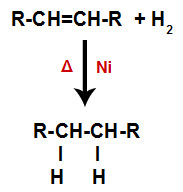
Esquema geral de uma reação de hidrogenação em alcenos
A presença do catalisador e o aquecimento fazem com que a ligação pi do alceno e a ligação sigma entre os hidrogênios do H2 sejam rompidas mais rapidamente. Com isso, temos a criação de dois sítios de ligação no alceno e dois átomos de hidrogênio livres no meio reacional.
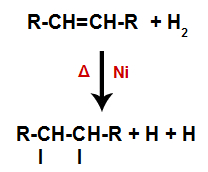
Criação de sítios de ligação e separação de átomos
Assim, logo em seguida, cada átomo de hidrogênio livre ocupa um dos sítios de ligação formados no alceno. Como a substância formada apresenta apenas carbonos e hidrogênios, bem como apenas ligações simples entre os carbonos, trata-se de um alcano.
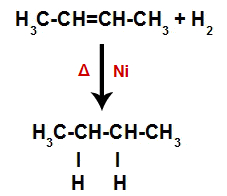
Equação representando a formação do alcano na hidrogenação
b) Halogenação
Um alceno é misturado com substâncias simples (F2, Cl2, Br2 e I2) formadas por halogênios (cloro, flúor, iodo e bromo) em um recipiente e submetido à ação de luz (λ) e aquecimento (Δ).
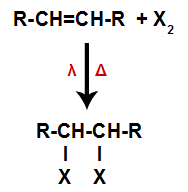
Esquema geral de uma reação de halogenação em alcenos
A ação da luz e o aquecimento fazem com que a ligação pi do alceno e a ligação sigma entre as substâncias formadas por halogênio sejam rompidas mais rapidamente. Com isso, temos a criação de dois sítios de ligação no alceno e dois átomos de halogênios livres no meio reacional.
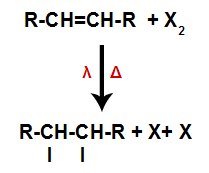
Criação de sítios de ligação e separação de átomos
Assim, logo em seguida, cada átomo de halogênio livre ocupa um dos sítios de ligação formados no alceno. Como a substância formada apresenta halogênio ligado a uma estrutura composta por carbonos e hidrogênios, trata-se de um haleto orgânico.
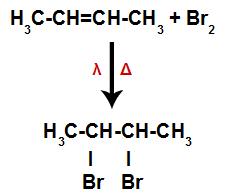
Equação representando a formação do haleto orgânico na halogenação
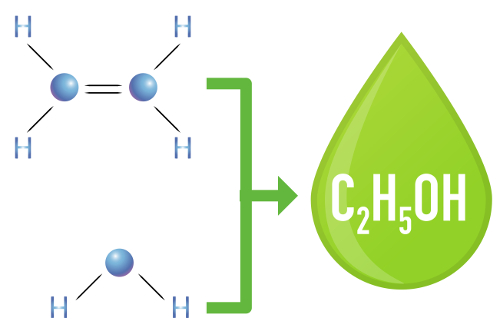
c) Hidratação
Um alceno é misturado com água (H2O) em um recipiente e submetido à ação de um catalisador (nesse caso, o ácido sulfúrico).
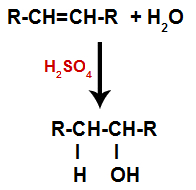
Esquema geral de uma reação de hidratação em alcenos
A presença do ácido sulfúrico na reação faz com que a ligação pi do alceno e a ligação sigma entre o hidrogênio (H) e a hidroxila (OH) da água sejam rompidas mais rapidamente. Com isso, temos a criação de dois sítios de ligação no alceno e um hidrogênio e uma hidroxila livres no meio reacional.
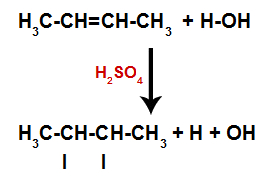
Criação de sítios de ligação e separação de átomos
Assim, logo em seguida, o hidrogênio e a hidroxila ocupam um dos sítios de ligação formados no alceno. Como a substância formada apresenta hidroxila ligada a um carbono saturado (só realiza ligações simples), trata-se de um álcool.
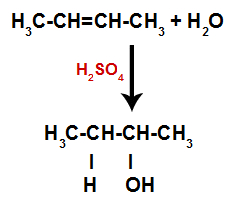
Equação representando a formação do álcool na hidratação
d) Adição com haletos de hidrogênio
Um alceno é misturado com um ácido inorgânico halogenado (HF, HI, HCl, HBr) em um recipiente.
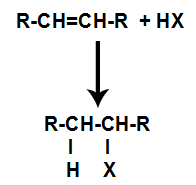
Esquema geral de uma reação com haleto de ácido em alcenos
A presença de ácido na reação faz com que a ligação pi do alceno seja rompida mais rapidamente. A ligação simples no ácido é rompida porque essas substâncias sofrem ionização naturalmente. Com isso, são criados dois sítios de ligação no alceno e há a presença de um hidrogênio e de um halogênio livres no meio reacional.
.jpg)
Criação de sítios de ligação e separação de átomos
Assim, logo em seguida, o hidrogênio e o halogênio ocupam um dos sítios de ligação formados no alceno. Como a substância formada apresenta halogênio ligado a uma estrutura composta por carbonos e hidrogênios, trata-se de um haleto orgânico.
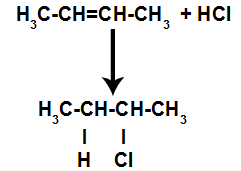
Equação representando a formação do haleto orgânico na halogenação
Por Me. Diogo Lopes Dias