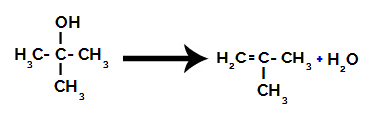
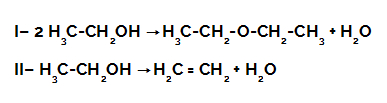As reações de eliminação, também conhecidas como reações de desidratação, são aquelas nas quais compostos orgânicos formam novas substâncias a partir da perda de componentes (átomos de elementos químicos) que faziam parte da composição química deles. Veja um exemplo:
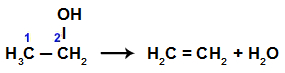
Equação química que representa a formação de um alceno
Na equação, verifica-se a ocorrência de reação de eliminação porque temos no reagente a substância 1 (um álcool) e no produto um alceno e uma molécula de água.
O grupo OH que estava ligado ao carbono 1 do álcool interagiu com um hidrogênio do carbono 2, formando a molécula de água. Para que os carbonos 1 e 2 não ficassem sem uma ligação, após a saída do OH e do hidrogênio, foi criada uma ligação pi entre eles, resultando em um alceno.
Ocorrência das reações de eliminação
Reações de eliminação ocorrem com os seguintes compostos orgânicos:
-
Não pare agora... Tem mais depois da publicidade ;)
Substâncias que apresentam o grupo hidroxila (OH) ligado a um átomo de carbono saturado (faz apenas ligações simples).
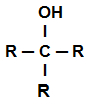
Estrutura geral de um álcool
OBS.: O grupo R pode ser um hidrogênio ou um radical qualquer.
Substâncias que apresentam o grupo carboxila (carbono ligado a uma hidroxila e a um oxigênio).
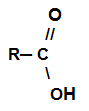
Estrutura geral de um ácido carboxílico
OBS.: O grupo R pode ser um hidrogênio ou um radical qualquer.
Substâncias que apresenta halogênio X (Flúor, Cloro, Bromo e Iodo) ligado a um carbono.
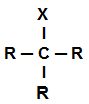
Estrutura geral de um haleto
OBS.: O grupo R pode ser um hidrogênio, um radical ou outro halogênio.
Tipos de reações de eliminação
Existem apenas dois tipos de reações de eliminação: a eliminação intermolecular e a eliminação intramolecular:
a) Reação de eliminação intermolecular
É a reação de eliminação que ocorre entre duas moléculas. Quando as moléculas interagem, elas se unem e, por isso, ambas perdem átomos. Logo, ocorre a formação de um novo composto orgânico e água.
Veja um exemplo:
Duas moléculas de propan-2-ol sofrem eliminação intermolecular:
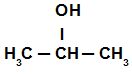
Fórmula estrutural do propan-2-ol
Uma molécula de propan-2-ol perde o grupo OH do carbono 2, e a outra molécula de propan-2-ol perde o hidrogênio da hidroxila (grupo OH), resultando em uma molécula de água (H2O).
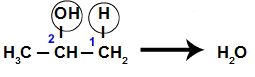
Equação da perda de átomos nas moléculas de propan-2-ol
Em seguida, o carbono 2 de uma molécula de propan-2-ol une-se ao oxigênio da outra molécula de propan-2-ol, formando um éter.
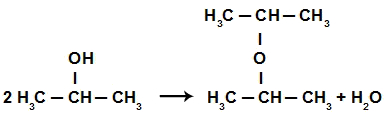
Criação do éter na reação de eliminação do propan-2-ol
b) Reação de eliminação intramolecular
É a reação de eliminação em que um grupo de átomos sai de uma única molécula, resultando em uma molécula de água e um novo composto orgânico. Veja um exemplo:
Uma molécula de propan-1-ol sofre eliminação intramolecular:
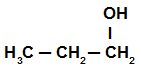
Fórmula estrutural do propan-1-ol
O grupo OH do carbono 1 interage com um dos hidrogênios do carbono 2, formando uma molécula de água.
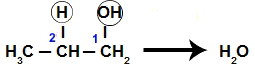
Formação da água a partir do propan-1-ol
Como os carbonos 1 e 2 perderam uma ligação, uma ligação pi é criada entre eles para alcançarem a estabilidade.
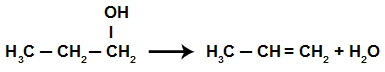
Criação da ligação pi na reação de eliminação do propan-1-ol
Condições para a ocorrência de uma reação de eliminação
A ocorrência de uma reação de eliminação depende de três fatores:
-
Reagente;
-
Temperatura a que a reação está sendo submetida;
-
Uso de um agente desidratante ou catalisador (substância que provoca a formação de uma molécula de água a partir de componentes presentes em uma determinada molécula).
Por isso, é importante conhecermos as particularidades da reação de eliminação em cada um dos compostos orgânicos:
a) Para os álcoois
Os álcoois são substâncias que podem sofrer reação de eliminação tanto intermolecular quanto intramolecular. Em ambos os casos, o agente desidratante é o mesmo (ácido sulfúrico concentrado). O que diferencia cada tipo é a temperatura na qual o processo ocorre.
- Intermolecular
Reação de eliminação dos álcoois na presença de ácido sulfúrico concentrado, em uma temperatura de 140moC. O produto gerado é sempre um éter. Veja um exemplo:
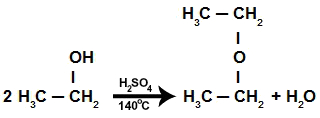
Equação da reação de eliminação intermolecular do etanol
- Intramolecular
Reação de eliminação dos álcoois na presença de ácido sulfúrico concentrado, em uma temperatura de 170oC. O produto gerado é sempre um alceno. Veja um exemplo:
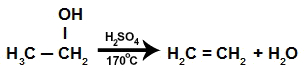
Equação da reação de eliminação intramolecular do etanol
b) Para os ácidos carboxílicos
Como os ácidos carboxílicos apresentam a carboxila, que é um grupo com dois átomos eletronegativos (capazes de atrair elétrons das ligações com outros átomos), e um átomo de hidrogênio ionizável (hidrogênio ligado a um oxigênio), eles realizam apenas a reação de eliminação intermolecular.
Diferentemente dos álcoois, na eliminação dos ácidos carboxílicos, diferentes agentes desidratantes podem ser utilizados, como o ácido fosfórico (H3PO4), ácido sulfúrico (H2SO4) e pentóxido de difósforo (P2O5), sempre a uma temperatura de 140 oC.
Uma molécula de ácido carboxílico perde o grupo OH de sua carboxila, e a outra molécula de ácido perde o hidrogênio do grupo OH de sua carboxila, resultando em uma molécula de água (H2O). Em seguida, o carbono que perdeu o grupo OH une-se ao oxigênio que perdeu o hidrogênio, formando um anidrido. Veja um exemplo:
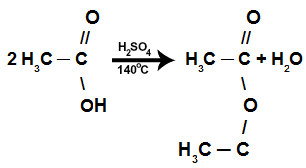
Equação da reação de eliminação intermolecular do ácido etanoico
c) Para os haletos orgânicos
A reação de eliminação em haletos orgânicos é um caso particular, já que, para que ela ocorra, são necessárias elevadas temperaturas, um solvente (um álcool) não muito polar e, principalmente, uma base forte, como o hidróxido de potássio (KOH).
Nessa reação, há a saída do halogênio de um carbono e a saída de um hidrogênio de outro carbono do haleto orgânico. O halogênio e o hidrogênio que saíram do haleto ligam-se, respectivamente, ao metal (potássio) e à hidroxila (OH) provenientes da base inorgânica.
Os produtos formados são água, um sal inorgânico e um alceno (porque uma ligação pi é formada entre os carbonos do haleto que perderam halogênio e hidrogênio).
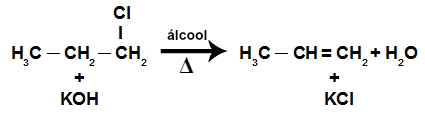
Equação da reação de eliminação em um haleto orgânico
Por Me. Diogo Lopes Dias