A geometria molecular, isto é, a disposição dos átomos de uma molécula, pode ser determinada pela regra do químico Gillespie, na qual ele relaciona o número de átomos ligados a um átomo central e o número de nuvens eletrônicas.
O conhecimento sobre a geometria de uma molécula é extremamente importante porque nos ajuda a determinar a polaridade e, consequentemente, a solubilidade (segundo a regra do semelhante dissolve semelhante).
Com a chamada geometria tetraédrica, não é diferente. Veja os critérios para determiná-la de acordo com as regras de Gillespie:
-
Moléculas pentatômicas (cinco átomos);
-
Ausência de nuvens eletrônicas no átomo central;
-
Moléculas compostas ou ânions compostos.
Alguns exemplos de moléculas cuja geometria é tetraédrica são:
-
CH4
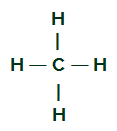
Fórmula estrutural do CH4
O carbono apresenta quatro elétrons na sua camada de valência e todos esses elétrons realizam ligações com os hidrogênios. É por isso que o carbono não apresenta nuvem eletrônica (par de elétrons sobrando).
-
SO4-2
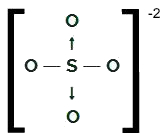
Fórmula estrutural do SO4-2
O enxofre, que possui seis elétrons na camada de valência, realiza duas ligações simples com dois átomos de oxigênio e duas ligações covalentes dativas com os outros dois oxigênios. Nas ligações simples, ele utiliza dois dos seus elétrons e, em cada dativa, utiliza outros dois (total de quatro elétrons envolvidos em dativas), totalizando seis elétrons. Sendo assim, ele não apresenta nuvem sobrando.
-
NH4+
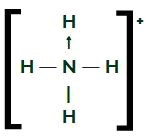
Fórmula estrutural do NH4+
O nitrogênio, que possui cinco elétrons na camada de valência, realiza três ligações simples com os átomos de hidrogênio e uma dativa com o outro hidrogênio. Nas ligações simples, ele utiliza três dos seus elétrons e, na dativa, utiliza outros dois, totalizando cinco elétrons. Sendo assim, ele não apresenta nuvem sobrando.
-
CH3Cl
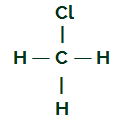
Fórmula estrutural do CH3Cl
O carbono apresenta quatro elétrons na sua camada de valência e todos esses elétrons estão realizando ligações com os hidrogênios e o átomo de cloro. Por essa razão, o carbono não apresenta nuvem eletrônica.
→ Polaridade da Molécula
Sabendo que uma determinada molécula apresenta geometria tetraédrica, podemos determinar sua polaridade de forma extremamente simples, já que a molécula possui seus quatro polos ocupados (quatro ligantes no átomo central). Para isso, basta conhecer as características dos ligantes e considerar uma das regras a seguir:
-
Se o número de nuvens for igual ao número de ligantes iguais = molécula apolar;
-
Se o número de nuvens for diferente do número de ligantes iguais = molécula polar.
Nas duas moléculas a seguir, cuja geometria é tetraédrica, podemos aplicar as regras acima e indicar a polaridade delas:
-
Molécula do metano
Não pare agora... Tem mais depois da publicidade ;)
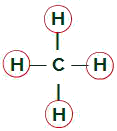
Ligantes iguais na molécula do Metano
A molécula do metano apresenta quatro nuvens eletrônicas (quatro ligações simples) e também quatro átomos de hidrogênio ligados ao átomo central. Assim, temos quatro nuvens e quatro ligantes iguais, logo, a molécula é apolar.
Observação: Se a molécula da substância é apolar, ela se dissolve bem em outra substância cujas moléculas também sejam apolares.
-
Molécula do clorometano
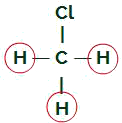
Ligantes iguais na molécula do clorometano
A molécula do clorometano possui quatro nuvens eletrônicas (quatro ligações simples) e três átomos de hidrogênio e um átomo de cloro ligados ao átomo central. Assim, temos quatro nuvens e três ligantes iguais (três hidrogênios); logo, a molécula é polar.
Observação: Se a molécula da substância é polar, ela se dissolve bem em outra substância cujas moléculas também sejam polares.
Por Me. Diogo Lopes Dias