A geometria angular é um dos vários tipos de geometria molecular, que é a forma como os átomos de uma molécula estão organizados no espaço. Ela apresenta como principal propriedade o fato de o átomo central orientar a forma como os outros átomos da molécula devem ser organizados no espaço.
Trata-se de um tipo de geometria que apresenta características bem particulares, a saber:
-
Ocorre apenas em moléculas triatômicas, ou seja, aquelas que apresentam apenas três átomos (iguais ou diferentes) em sua composição;
-
O átomo central da molécula deve apresentar seis elétrons de valência;
-
No átomo central deve existir pelo menos um par de elétrons que não participam de ligações químicas;
-
O padrão da fórmula estrutural das moléculas que possuem essa geometria é o seguinte:
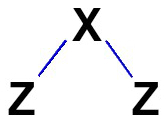
Ângulos possíveis na geometria angular
De acordo com a teoria da repulsão de pares eletrônicos, quando em uma molécula existem dois ou mais pares de elétrons em volta de um átomo central, automaticamente essas nuvens eletrônicas repelem-se entre si. Essa repulsão entre os pares eletrônicos promove a organização dos átomos em volta do átomo central.
Como um par eletrônico repele o outro, entre eles surgem um distanciamento e, consequentemente, um ângulo. De forma geral, os valores dos ângulos determinados para a geometria molecular angular são 120o e 109o 28', de acordo com os seguintes critérios:
-
Ângulo de 120o: quando o átomo central da molécula apresenta um par de elétrons não ligantes;
-
Ângulo de 109o 28': quando o átomo central da molécula apresenta dois pares de elétrons não ligantes.
Obs.: Vale ressaltar que os valores dos ângulos propostos acima são padronizados para facilitar o aprendizado, mas cada molécula apresenta uma particularidade e, consequentemente, um valor de ângulo entre suas nuvens eletrônicas.
Exemplos
→ Moléculas de água (H2O)
A água é uma substância cujas moléculas apresentam duas ligações simples entre o átomo de oxigênio e cada um dos átomos de hidrogênio, como podemos observar na fórmula estrutural a seguir:
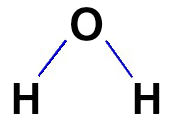
Como cada ligação simples representa o compartilhamento de dois elétrons, podemos construir a fórmula eletrônica da molécula de água da seguinte forma:
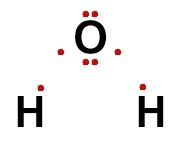
A água é uma substância cujas moléculas possuem geometria angular porque ela apresenta as seguintes características:
-
Molécula triatômica (três átomos);
-
O átomo central apresenta elétrons não ligantes (dois pares), já que dois dos seus seis elétrons de valência participam das ligações com os hidrogênios;
Não pare agora... Tem mais depois da publicidade ;) -
Possui um ângulo geral de 109o 28' entre as nuvens eletrônicas do átomo central.
→ Moléculas do dióxido de enxofre (SO2)
O dióxido de enxofre é uma substância cujas moléculas apresentam uma ligação dupla e uma ligação covalente dativa entre o átomo de enxofre e cada um dos átomos de oxigênio, como podemos observar na fórmula estrutural a seguir.
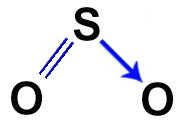
Como a ligação dupla representa o compartilhamento de quatro elétrons e a ligação dativa representa o compartilhamento de dois elétrons, a fórmula eletrônica da molécula do dióxido de enxofre é a seguinte:
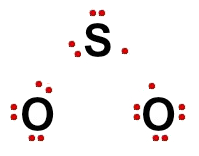
O dióxido de enxofre apresenta geometria angular porque possui as seguintes características:
-
Molécula triatômica (três átomos);
Não pare agora... Tem mais depois da publicidade ;) -
O átomo central apresenta elétrons não ligantes (um par apenas), já que quatro dos seus seis elétrons de valência participam das ligações com os oxigênios;
-
Possui um ângulo geral de 120o entre as nuvens eletrônicas do átomo central.
→ Moléculas de ozônio (O3)
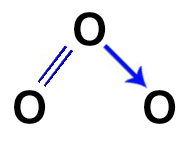
O ozônio é uma substância cujas moléculas apresentam uma ligação dupla e uma ligação covalente dativa entre o átomo de enxofre e cada um dos átomos de oxigênio, como podemos observar a seguir:
Como a ligação dupla representa o compartilhamento de quatro elétrons e a ligação dativa representa o compartilhamento de dois elétrons, a fórmula eletrônica da molécula do ozônio é a seguinte:
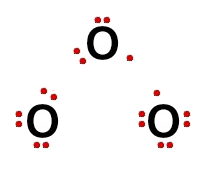
O ozônio apresenta geometria angular porque possui as seguintes características:
-
Molécula triatômica (três átomos);
-
O átomo central apresenta elétrons não ligantes (um par apenas), já que quatro dos seus seis elétrons de valência participam das ligações com os oxigênios;
-
Possui um ângulo geral de 120o entre as nuvens eletrônicas do átomo central.
Por Me. Diogo Lopes Dias
