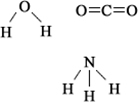
A polaridade de uma ligação e de uma molécula está relacionada à distribuição dos elétrons ao redor dos átomos. Se essa distribuição for simétrica, a molécula será apolar, mas se for assimétrica, sendo que uma das partes da molécula possui maior densidade eletrônica, então se trata de uma molécula polar.
A polaridade das moléculas pode ser visualizada quando a sua substância constituinte é submetida a um campo elétrico externo. Se as moléculas se orientarem na presença desse campo, ou seja, se uma parte for atraída pelo polo positivo e a outra parte da molécula for atraída pelo polo negativo, então, elas são polares. Do contrário, se elas não se orientarem, elas são apolares.
Por exemplo, quando atritamos bastante um bastão de vidro com uma flanela, ele fica carregado positivamente. Se o aproximarmos de um filete de água que cai de uma torneira, veremos que a água não continuará caindo na trajetória retilínea na vertical, mas ela será atraída pelo bastão, sofrendo um desvio. Isso mostra que a água é polar. Mas se fizermos essa mesma experiência com um filete de óleo, ele não sofrerá desvio na sua trajetória, mostrando que suas moléculas são apolares.
Ao analisarmos as estruturas das moléculas, podemos determinar se elas são polares ou não, levando em consideração dois fatores importantes: a diferença de eletronegatividade entre os átomos e a geometria da molécula.
1º) Eletronegatividade entre os átomos:
Se a molécula for formada por ligações entre átomos dos mesmos elementos químicos, isto é, se forem substâncias simples, tais como O2, H2, N2, Cℓ2, P4, S8, etc., elas serão apolares, porque não há diferença de eletronegatividade entre os seus átomos.
A única exceção é a molécula de ozônio (O3), que será vista mais adiante.
Se a molécula for diatômica e formada por elementos de eletronegatividades diferentes, então, a molécula será polar. Exemplos: HCℓ, HF, HBr e HI.
2º) Geometria da molécula:
A geometria da molécula interfere em como os elétrons estarão distribuídos nela e, consequentemente, na sua polaridade. Se a molécula for formada por três átomos ou mais, teremos que analisar cada ligação que é feita e a geometria da molécula. Veja um exemplo: CO2 – molécula linear:
δ- δ+ δ-
O = C = O
Observe que o oxigênio é mais eletronegativo que o carbono, por isso, os elétrons das ligações são mais atraídos para os oxigênios. Neles é formada uma carga parcial negativa (δ-), enquanto no carbono é formada uma carga parcial positiva (δ+). A multiplicação da distância entre os núcleos dos átomos ligados com essas cargas em módulo (isto é, somente o número sem sinal de positivo ou negativo) é chamada de momento dipolar e é representada por μ.
μ = d . |δ|
Esse momento dipolar é indicado por setas que apontam na direção do elemento mais eletronegativo, que atrai os elétrons: O ← C → O. Isso mostra que essa grandeza é um vetor (grandeza que apresenta módulo ou intensidade, direção e sentido). Portanto, ele é mais bem representado por: 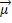 .
.
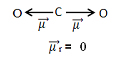
Somando-se todos os vetores, encontramos o momento dipolar resultante, 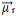 , que nesse caso deu igual a zero porque os dois momentos dipolares possuem valores iguais, mas vão em direções opostas, anulando-se.
, que nesse caso deu igual a zero porque os dois momentos dipolares possuem valores iguais, mas vão em direções opostas, anulando-se.
Quando o vetor momento dipolar resultante der igual a zero, a molécula é apolar, mas se der diferente de zero, ela será polar.
Portanto, no caso da molécula de CO2, ela é apolar.
Agora, veja outro exemplo: H2O – geometria angular (porque o oxigênio possui dois pares de elétrons disponíveis no nível mais externo, que repelem os elétrons das ligações com os hidrogênios):
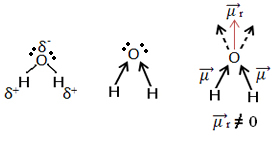
Os elétrons são atraídos para o oxigênio. Mas, nesse caso, os vetores não se anulam, porque a geometria molecular da água é angular, já que suas direções não são opostas, dando um vetor momento dipolar resultante diferente de zero e, portanto, a molécula de água é polar.
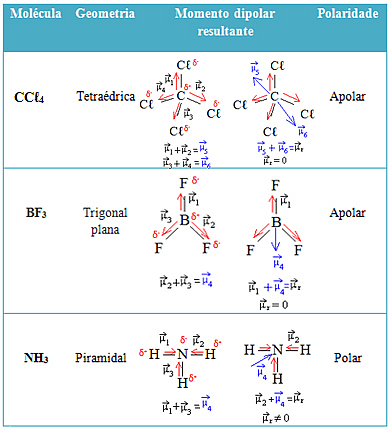
Veja mais exemplos na tabela abaixo:
Por Jennifer Fogaça
Graduada em Química