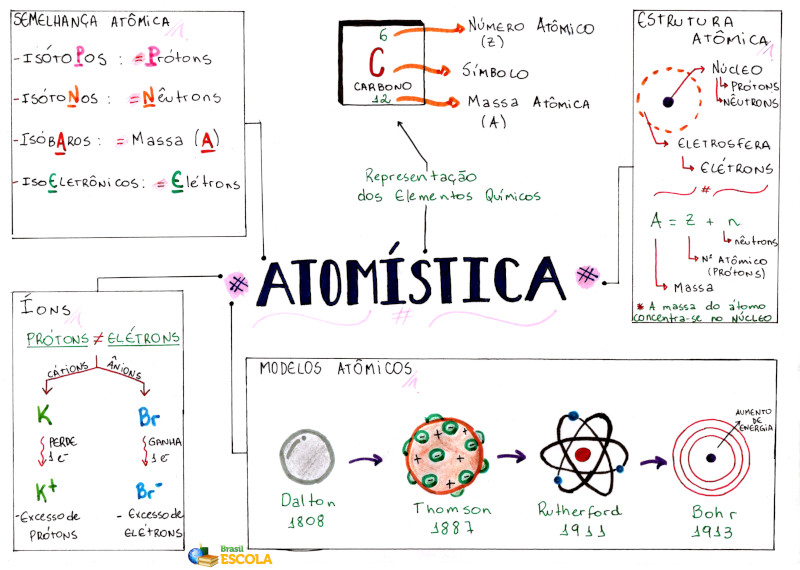
A atomística é a parte da Química que trata do estudo do átomo e suas características. Cabe a esse segmento definir a estrutura atômica, bem como o histórico de elaboração dos nossos modelos atômicos, os tipos de semelhanças entre os átomos, a representação dos elementos químicos e as notações envolvidas.
O átomo é a unidade básica da matéria que compõe todas as substâncias existentes. A palavra átomo é de origem grega e significa “sem parte” ou “indivisível”. Atualmente, já são conhecidas as chamadas partículas subatômicas, que comprovam que o átomo é divisível, porém foi mantido seu nome, devido ao tempo que vinha sendo utilizado.
Leia também: Estrutura do Átomo
Tópicos deste artigo
- 1 - Estrutura do átomo
- 2 - Eletrosfera
- 3 - Mapa mental: Atomística
- 4 - Notações importantes
- 5 - Videoaula: Atomística
- 6 - Semelhança atômica
- 7 - História
- 8 - Exercício resolvido
Estrutura do átomo
.jpg)
O modelo atual do átomo propõe que ele esteja dividido em duas regiões principais: o núcleo, em que estão concentradas as partículas positivas ou prótons, e os nêutrons, que são partículas sem carga necessárias para dar estabilidade ao núcleo. Ainda há a eletrosfera, região onde os elétrons orbitam ao redor do núcleo.
Eletrosfera
O conceito de eletrosfera apareceu em 1911, com o modelo atômico proposto por Rutherford, que disse que os elétrons estavam girando em órbitas ao redor do núcleo em espaços vazios, semelhante ao Sistema Solar.
Com o avanço dos modelos atômicos, a eletrosfera foi sofrendo algumas alterações nas suas características. Bohr, por exemplo, reformulou o modelo atômico proposto por Rutherford organizando os elétrons da eletrosfera em órbitas de energias.
A eletrosfera é dividida em 7 órbitas, que possuem energia fixa que aumenta proporcionalmente com sua distância do núcleo. Essas órbitas (ou camadas) são denominadas K, L, M, N, O, P e Q, sendo a camada K a mais próxima e de menor energia e a camada Q a mais distante e com maior energia.
A relação de tamanho entre o núcleo e a eletrosfera gira em torno de 10.000 a 100.000 vezes, ou seja, a eletrosfera é bem maior que o núcleo do seu átomo. Isso nos mostra que o átomo é formado em sua maior parte por espaços vazios.
Leia também: Tabela Periódica
Mapa mental: Atomística
Notações importantes
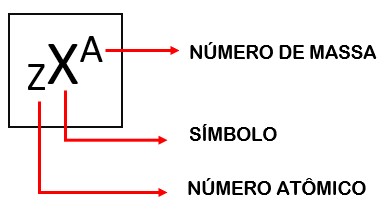
Com base na estrutura do átomo, podemos extrair informações que explicam algumas características químicas e físicas dos elementos químicos. O número atômico, representado pela letra Z, indica a quantidade de prótons existentes no núcleo de cada átomo. Também serve como forma de identificação dos átomos, uma vez que não existem átomos diferentes com a mesma quantidade de prótons.
Isso nos leva à definição de elemento químico: o conjunto de átomos que possuem o mesmo número atômico. É dessa forma que representamos os átomos na Tabela Periódica, por um conjunto de átomos dispostos em ordem crescente de número atômico.
Outra informação importante que podemos retirar da estrutura atômica é o número de massa, representado pela letra A. Uma vez que a massa do átomo está concentrada no núcleo, já que o elétron possui massa desprezível em relação aos prótons e nêutrons, podemos calcular a massa do átomo somando a quantidade de prótons e nêutrons do núcleo. Segue a fórmula:
A = Z + n ou A = p + n
A representação dos átomos na forma de elementos químicos inclui algumas dessas informações, bem como o símbolo utilizado para representá-los. Obrigatoriamente, a representação de um elemento químico deve conter seu número de massa, seu número atômico e seu símbolo.
Algumas tabelas periódicas complementam essas informações com estado físico, distribuição eletrônica, propriedades periódicas etc.
A ideia de Thomson de um átomo neutro (mesma quantidade de partículas positivas e negativas) manteve-se no decorrer da evolução dos modelos atômicos. Quando essa neutralidade ocorre, dizemos que os átomos encontram-se em seu estado fundamental, isto é, o número de prótons no núcleo é igual ao número de elétrons na eletrosfera.
Quando essa igualdade não é mantida, dizemos que os átomos tornaram-se íons — o número de prótons é diferente do número de elétrons. Isso ocorre quando o átomo ganha ou perde elétrons, a fim de alcançar um estado de menor energia, um estado mais estável.
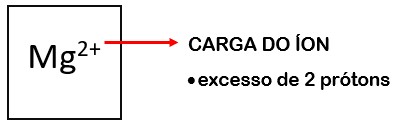
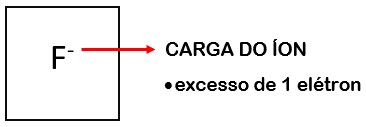
Quando o átomo perde elétrons, ele passa a ter mais prótons, tornando-se positivamente carregado. Ao íon positivo, ou seja, com excesso de prótons, damos o nome de cátion. Quando o átomo ganha elétrons, ele se torna negativamente carregado, ou seja, tem mais elétrons do que prótons. Ao íon negativo, com excesso de elétrons, damos o nome de ânion.
A seguir, demonstraremos dois exemplos:
-
o íon Mg2+, que perdeu dois elétrons e tornou-se um cátion bivalente;
-
e o íon F-, que recebeu um elétron e tornou-se um ânion monovalente.
Como podemos aplicar essas informações a respeito dos íons? Vejamos um exemplo do íon cádmio ![]() e como calcular a quantidade de suas partículas subatômicas e de sua massa.
e como calcular a quantidade de suas partículas subatômicas e de sua massa.
Com base na representação do íon, podemos retirar as seguintes informações: A = 112 e Z= 48 ou p = 48
Pela fórmula A = p + n, podemos calcular o número de nêutrons:
A = p + n
112 = 48 + n
n = 112 – 48
n = 64
Por ser um cátion bivalente, seu número de elétrons é duas unidades menor que o número de prótons, portanto: 48 – 2 = 46 elétrons.
Saiba também: Raio iônico
Videoaula: Atomística
Semelhança atômica
Quando comparamos dois átomos, podemos encontrar algumas semelhanças nas quantidades de partículas subatômicas presentes em suas estruturas ou ainda na sua massa. E para cada tipo de semelhança, temos uma classificação diferente:
-
Isótopos
Ocorrem quando dois átomos apresentam o mesmo número de prótons (p), ou seja, possuem o mesmo número atômico (Z). Veja o exemplo dos isótopos do carbono:
|
ISÓTOPOS |
PARTÍCULAS SUBATÔMICAS |
||
|
|
PRÓTONS |
NÊUTRONS |
ELÉTRONS |
|
CARBONO 12 – 12C |
6 |
6 |
6 |
|
CARBONO 13 – 13C |
6 |
7 |
6 |
|
CARBONO 14 – 14C |
6 |
8 |
6 |
Como a quantidade de prótons e a quantidade de elétrons são iguais para átomos neutros, átomos isótopos terão também o mesmo número de elétrons quando não estivermos comparando átomos neutros e íons. Note também que átomos isótopos possuem diferentes números de nêutrons e de massa.
-
Isótonos
Ocorrem quando dois átomos possuem a mesma quantidade de nêutrons no núcleo. Veja o exemplo em que são comparados um átomo de cálcio e um átomo de cloro:
|
ISÓTONOS |
PARTÍCULAS SUBATÔMICAS |
||
|
|
PRÓTONS |
NÊUTRONS |
ELÉTRONS |
|
20Ca40 |
20 |
20 |
20 |
|
17Cl 37 |
17 |
20 |
17 |
Nesse caso, a única semelhança entre os átomos está no número de nêutrons, diferindo-se em todos os outros aspectos.
-
Isóbaros
São átomos que possuem semelhança no número de massa, como o potássio e o argônio:
|
ISÓBÁROS |
PARTÍCULAS SUBATÔMICAS |
||
|
|
PRÓTONS |
NEUTRONS |
ELÉTRONS |
|
19K40 |
19 |
21 |
19 |
|
20Ar40 |
20 |
20 |
20 |
Apesar das diferenças nas partículas que compõem o núcleo desses átomos, eles possuem a mesma massa atômica.
-
Isoeletrônicos
Quando duas espécies químicas (átomos ou íons) apresentam o mesmo número de elétrons. No caso dos íons, deve-se levar em conta sua carga para identificar a quantidade de elétrons. Veja no exemplo:
|
ISOELETRÔNICOS |
PARTÍCULAS SUBATÔMICAS |
||
|
|
PRÓTONS |
NEUTRONS |
ELÉTRONS |
|
12 Mg+2 24 |
12 |
12 |
10 |
|
10 Ne 20 |
10 |
10 |
10 |
Obs.: Átomos neutros isótopos também são classificados como isoeletrônicos.
-
Exemplos
Veja, a seguir, como são trabalhados os conceitos de semelhanças atômicas:
-
Dois átomos (A e B) são isóbaros. O átomo A tem número de massa igual a 7x + 5 e número atômico igual a 5x – 4. O átomo B tem número de massa igual a 9x – 3. Quais são o número atômico, o número de massa, o número de nêutrons e o número de elétrons do átomo A?
Para resolver essa questão, precisamos, primeiramente, encontrar o valor de x. Para isso, vamos igualar a massa do átomo A com a massa do átomo B, já que eles são isóbaros:
7x + 5 = 9x – 3
9x – 7x = 5 +3
2x = 8
x = 4
Com o valor de X, basta substituí-lo nas expressões fornecidas e encontrar as informações pedidas:
- Número atômico:
Z = 5x – 4
Z = 5 . 4 – 4
Z = 20 – 4
Z = 16
- Número de massa:
A = 7x + 5
A = 7 . 4 + 5
A = 28 + 5
A = 33
- Número de nêutrons:
A = p + n
33 = 16 + n
n = 33 – 16
n = 17
Portanto, o número atômico, o número de massa, o número de nêutrons e o número de elétrons do átomo A são, respectivamente: 16, 33, 17 e 16 (por ser um átomo neutro, p = e). Para saber mais sobre, acesse: Semelhanças atômicas.
História
A composição da matéria é estudada desde a Antiguidade, mais especificamente desde o século V a.C., quando os filósofos gregos Leucipo e Demócrito propuseram a explicação de que a matéria era constituída de pequenas partículas que não poderiam ser divididas e deram a essas partículas o nome de átomos.
Essa teoria vigorou por vários anos, até que o químico e físico inglês John Dalton, por volta de 1808, após estudos baseados nas leis ponderais e em experimentos, propôs que a matéria era formada por partículas de formato esférico, indivisível e sem carga.
Dentro dessa perspectiva, átomos que tivessem as mesmas características e propriedades seriam do mesmo elemento químico e sofreriam um rearranjo quando realizassem uma reação química. Esse modelo ficou conhecido como bola de bilhar, por ser esférico e maciço. Para saber mais sobre, leia: Modelo atômico de Dalton.
Com a diversificação das pesquisas e o aprofundamento dos experimentos, foram surgindo outros modelos mais plausíveis e que possibilitavam a explicação de outros fenômenos.
Assim, foi em 1887 que o físico britânico Joseph John Thomson alterou a ideia de partícula indivisível que se fazia do átomo. Por meio de experimentos com raios catódicos, ele descobriu o elétron, uma partícula de carga negativa que está presente na estrutura atômica.
Para explicar o caráter neutro da matéria, ele indicou que o átomo seria uma massa positiva, com os elétrons distribuídos uniformemente. Esse modelo ficou conhecido como o pudim de passas. Para saber mais sobre, leia: Modelo atômico de Thomson.
.jpg)
Em 1911, o físico Ernest Rutherford, nascido na Nova Zelândia, descobriu que o átomo não era uma esfera maciça, como indicavam os outros modelos, e sim uma estrutura com grandes espaços vazios. Ele fez essa descoberta após realizar experimentos para entender um pouco mais sobre a radioatividade e as partículas alfa, tendo sido essas, para tanto, bombardeadas em uma fina lâmina de ouro.
Nesse experimento, Rutherford pôde observar que algumas partículas alfa não atravessavam a lâmina de ouro, outras sofriam um desvio na trajetória, e a maioria delas passava direto, sem alteração na direção.
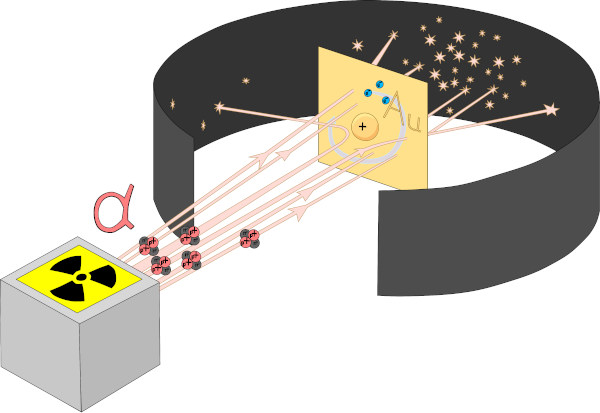
Após essas observações, Rutherford concluiu que o átomo era composto por um núcleo denso e positivo, em que estavam contidos os prótons, e os elétrons orbitavam ao redor do núcleo em um grande espaço vazio, chamado eletrosfera. Essa descrição lembra o Sistema Solar, nome pelo qual se designou esse modelo atômico. Para saber mais sobre, leia: Modelo atômico de Rutherford.
.jpg)
Baseado no modelo atômico de Rutherford, o físico dinamarquês Niels Bohr propôs uma reformulação do modelo atômico, e, assim, em 1913, surgiu o modelo de Bohr (em alguns casos, também chamado de Rutherford-Bohr), que explicava como os elétrons estavam distribuídos na eletrosfera. Para tanto, elaborou alguns postulados, a fim de descrever sua teoria:
-
Os elétrons movimentam-se ao redor do núcleo em órbitas circulares e com energias definidas, denominadas camadas eletrônicas.
-
Cada camada possui uma energia permitida para os elétrons, a qual aumenta à medida que se distancia do núcleo. Os elétrons não perdem ou ganham energia espontaneamente ao movimentarem-se na camada.
-
Os elétrons podem absorver energia e saltar para uma camada mais externa, porém de maneira instável. Quando o elétron retorna para sua camada de origem, ele emite a energia absorvida na forma de luz ou calor. Esse fenômeno é denominado salto quântico.
.jpg)
Leia também: Distribuição eletrônica de elétrons
Exercício resolvido
(Enem) Os núcleos dos átomos são constituídos de prótons e nêutrons, sendo ambos os principais responsáveis pela sua massa. Nota-se que, na maioria dos núcleos, essas partículas não estão presentes na mesma proporção. O gráfico mostra a quantidade de nêutrons (N) em função da quantidade de prótons (Z) para os núcleos estáveis conhecidos.
.png)
Gráfico com quantidade de prótons e nêutrons. (Foto: Reprodução/Enem)
O antimônio é um elemento químico que possui 50 prótons e possui vários isótopos ― átomos que só se diferem pelo número de nêutrons. De acordo com o gráfico, os isótopos estáveis do antimônio possuem
a) entre 12 e 24 nêutrons a menos que o número de prótons.
b) exatamente o mesmo número de prótons e nêutrons.
c) entre 0 e 12 nêutrons a mais que o número de prótons.
d) entre 12 e 24 nêutrons a mais que o número de prótons.
e) entre 0 e 12 nêutrons a menos que o número de prótons.
Analisando o gráfico, mais precisamente na linha dos 50 prótons, percebe-se que os isótopos possuem de 62 a 74 nêutrons, isto é, de 12 a 24 nêutrons a mais que o número de prótons do antimônio.
Gabarito: Letra D.

