O modelo atômico de Thomson foi proposto no ano de 1898 pelo físico inglês Joseph John Thomson ou, simplesmente, J.J. Thomson. Após ter diversas evidências experimentais sobre a existência do elétron, ele derrubou a teoria da indivisibilidade do átomo proposta por John Dalton.
Thomson, a partir de seu modelo, confirmou e provou a existência de elétrons (partículas com carga elétrica negativa) no átomo, ou seja, o átomo possui partículas subatômicas.
Tópicos deste artigo
- 1 - Mapa Mental: Modelo Atômico de Thomson
- 2 - Considerações propostas pelo modelo atômico de Thomson
- 3 - Novidades propostas ao átomo pelo modelo de Thomson
- 4 - Problemas apontados para o átomo de Thomson
Mapa Mental: Modelo Atômico de Thomson
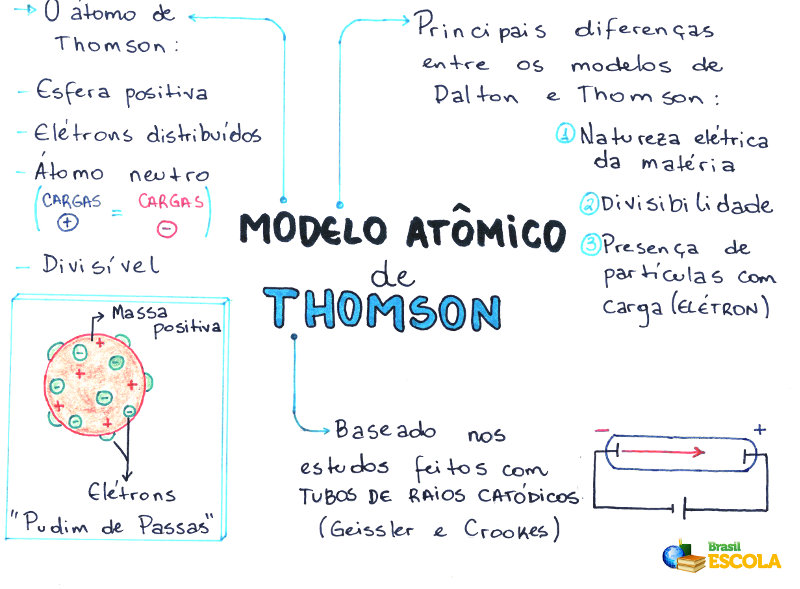
* Baixe o mapa mental sobre o modelo atômico de Thomson!
Thomson propôs seu modelo atômico tendo como base descobertas relacionadas com a radioatividade e experimentos realizados com o tubo de raios catódicos construído pelos cientistas Geissler e Crookes. Veja uma representação desse tubo:
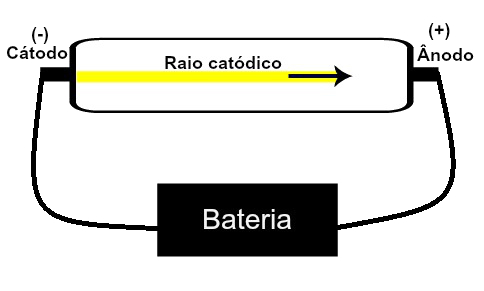
Quando um gás rarefeito, em baixa pressão, é submetido a uma alta tensão elétrica (por exemplo, 15000 V), produz um feixe de luz (composto por cargas elétricas) que parte do cátodo (polo negativo) em direção ao ânodo (polo positivo).
Com esse experimento, Thomson chegou à conclusão de que, quando os átomos do material gasoso no interior do tubo eram submetidos a uma alta tensão, seus elétrons eram arrancados e direcionados até a placa positiva.
Considerações propostas pelo modelo atômico de Thomson
Com os experimentos realizados com o tubo de raios catódicos, Thomson propôs sua interpretação de como seria o átomo e sua constituição. Assim, de acordo com ele:
-
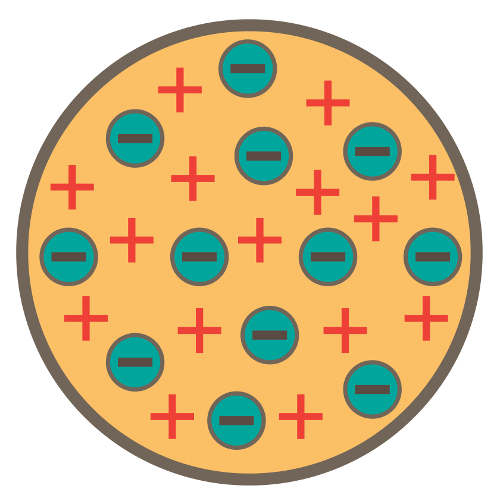
O átomo é uma esfera, mas não maciça como propunha o modelo atômico de John Dalton;
-
O átomo é neutro, já que toda matéria é neutra;
-
Como o átomo apresenta elétrons, que possuem cargas negativas, logo, deve apresentar partículas positivas para que a carga final seja nula;
-
Os elétrons não estão fixos ou presos no átomo, podendo ser transferidos para outro átomo em determinadas condições;
-
O átomo pode ser considerado como um fluido contínuo de cargas positivas onde estariam distribuídos os elétrons, que possuem carga negativa;
-
Associou o seu modelo a um pudim de passas (as quais representam os elétrons);
-
Como os elétrons que estão espalhados apresentam a mesma carga, existe entre eles uma repulsão mútua, o que faz com que estejam uniformemente distribuídos na esfera.
Novidades propostas ao átomo pelo modelo de Thomson
O modelo atômico de Thomson foi o segundo proposto para o átomo. O primeiro modelo foi formulado por John Dalton.
O modelo de Thomson tratou de novos conhecimentos sobre o átomo que até então não haviam sido propostos por falta de embasamento cientifico, como:
-
Natureza elétrica da matéria;
-
Divisibilidade do átomo;
-
Presença de partículas pequenas e com carga no átomo.
Problemas apontados para o átomo de Thomson
Vários físicos na época da proposta do modelo atômico de Thomson, pautados nas teorias da Física Clássica, apontaram algumas incoerências presentes nesse modelo:
-
Thomson propôs que o átomo apresentava uma estabilidade em relação à distribuição uniforme dos elétrons, o que poderia ser modificado por influência de energia. Porém, a Física Clássica, com base no eletromagnetismo, não permite a existência de um sistema estável pautado apenas na repulsão entre as partículas de mesma carga;
-
Para Thomson, os elétrons estão distribuídos uniformemente no átomo, mas eles têm a capacidade de se deslocar de forma acelerada e, por isso, devem emitir radiação eletromagnética em certas frequências especificas. Todavia, isso não era observado.
-
O modelo de Thomson era muitas vezes ineficaz para explicar propriedades atômicas, como sua composição e organização.
* Mapa mental por Victor Ricardo Ferreira
Professor de Química