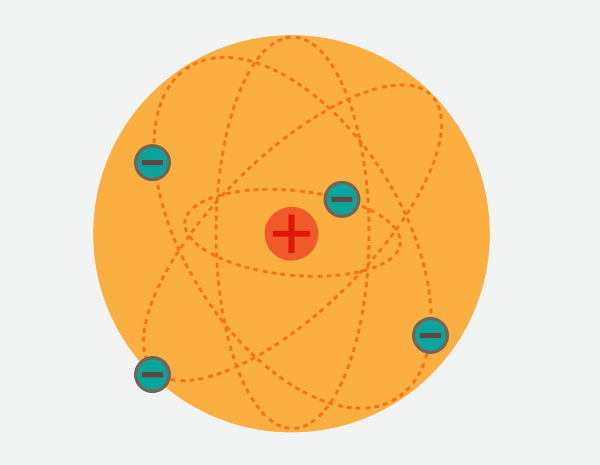
O modelo atômico de Rutherford é popularmente conhecido como o “modelo do sistema solar”, em alusão à estrutura proposta pelo cientista neozelandês em que o átomo é composto por duas regiões, o núcleo, denso, positivo e localizado no centro do átomo, e a eletrosfera, região que abriga os elétrons. No modelo proposto por Rutherford, os elétrons orbitam o núcleo, assim como os planetas orbitam o Sol.
O modelo atômico de Rutherford foi proposto com base em um experimento em que partículas alfa foram bombardeadas contra uma folha de ouro. Os resultados se demonstraram totalmente contrários à compreensão vigente do que seria o átomo, fazendo com que Rutherford atualizasse a estrutura atômica. Contudo, o modelo proposto por Rutherford apresenta problemas de estabilidade, os quais foram corrigidos por meio dos estudos de Niels Bohr e do desenvolvimento da mecânica quântica.
Leia também: Quais são os modelos atômicos?
Tópicos deste artigo
- 1 - Resumo sobre o modelo atômico de Rutherford
- 2 - Qual é o modelo atômico de Rutherford?
- 3 - Características do modelo atômico de Rutherford
- 4 - Experimento de Rutherford
- 5 - Falhas no modelo atômico de Rutherford
- 6 - Qual a importância do modelo atômico de Rutherford
- 7 - Outros modelos atômicos
- 8 - Exercícios resolvidos sobre o modelo atômico de Rutherford
Resumo sobre o modelo atômico de Rutherford
- O modelo atômico de Rutherford é popularmente conhecido como “modelo do sistema solar”.
- Segundo o modelo de Rutherford, o átomo é composto por um pequeno núcleo, denso e positivo, com cargas negativas em torno de si, semelhante aos planetas orbitando o Sol.
- Rutherford dividiu o átomo em duas regiões: núcleo e eletrosfera, sendo que o núcleo concentraria quase toda massa do átomo e teria um tamanho cerca de 100.000 menor que o átomo.
- O modelo atômico de Rutherford foi proposto após um experimento em que partículas alfa foram bombardeadas contra uma folha de ouro.
- O comportamento inesperado das partículas alfa fez Rutherford alterar a estrutura do átomo.
- O modelo de Rutherford, entretanto, apresenta grandes falhas de estabilidade, as quais foram corrigidas, posteriormente, por Neils Bohr com auxílio da mecânica quântica.
Qual é o modelo atômico de Rutherford?
O modelo atômico de Rutherford é o modelo atômico que foi desenvolvido por Ernest Rutherford e é popularmente conhecido como “modelo do sistema solar”, uma vez que seus experimentos resultaram em uma representação atômica em que as cargas positivas ficariam concentradas no núcleo, enquanto as cargas negativas, os elétrons, estariam em torno do núcleo, assim como os planetas ficam em torno do Sol.
Características do modelo atômico de Rutherford
O modelo atômico de Rutherford apresenta as seguintes características:
- O átomo é dividido em duas regiões: o núcleo e a eletrosfera.
- O núcleo concentra praticamente toda a massa do átomo, apresentando um raio de cerca de 10−15 m.
- O núcleo é composto exclusivamente por partículas positivas.
- A eletrosfera consiste em uma nuvem esférica na periferia do átomo.
- Na eletrosfera estão presentes os elétrons, de carga negativa, os quais descrevem uma órbita circular em torno do núcleo.
- A eletrosfera apresenta um raio de cerca de 10−10 m.
Experimento de Rutherford

O modelo atômico de Rutherford é derivado de um experimento, proposto por ele, mas realizado por seus assistentes, Hans Geiger e Ernest Marsden, em 1909. O físico neozelandês Ernest Rutherford foi um dos principais expoentes no desenvolvimento da radioatividade, tendo descoberto, por exemplo, que a radioatividade seria a transmutação natural de alguns elementos.
Outra descoberta de Rutherford foi a de que as partículas alfa (nomeadas por ele), descobertas na ionização produzida pelo urânio, podem sofrer desvios por campos elétricos e magnéticos. O cientista ainda percebeu que as partículas alfa poderiam ser desviadas levemente ao passarem pelo ar ou por uma fina camada de mica, um mineral do grupo dos silicatos.
Essas descobertas impulsionaram Rutherford a acreditar, então, que a matéria do átomo seria a fonte de forças elétricas muito intensas. Assim, designou Geiger e Mardsen para melhor entender o comportamento de partículas alfa quando estas atravessam a matéria, assim como seu espalhamento, possibilitando também a contagem de partículas alfa em fenômenos radioativos.
No experimento em questão, os assistentes bombardearam partículas alfa contra uma fina folha de ouro (de espessura de 10−6 m aproximadamente) em busca de medir os pequenos desvios que as partículas alfa sofreriam após interagir com a folha de ouro. Isso seria possível, pois, atrás da folha de ouro, havia um anteparo de sulfeto de zinco, que marcaria a colisão com as partículas alfa com pequenas manchas brilhosas, as quais seriam reveladas em uma câmara escura.
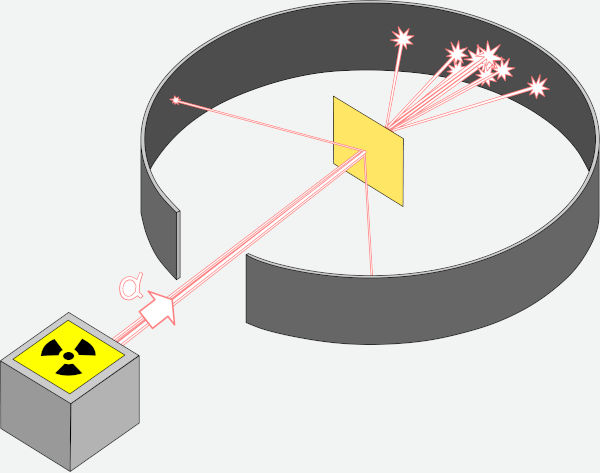
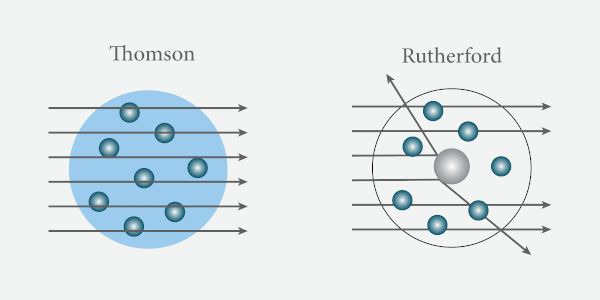
Para surpresa geral, aproximadamente uma partícula alfa, entre milhares que se chocaram contra a folha de ouro, sofreu um desvio acima de 90°, o que ia totalmente contra o modelo atômico vigente de Thomson, que, segundo sua estrutura, só permitia desvios em pequenos ângulos.
Os experimentos fizeram Rutherford sugerir modificações para a estrutura atômica, donde se destacam:
- a massa e a carga positiva do átomo se concentram no núcleo, que teria cerca de 1/100.000 do tamanho do átomo;
- os elétrons, de carga negativa, giram em torno do núcleo.
A imagem a seguir compara os resultados esperados de acordo com cada modelo atômico proposto.
Veja também: Qual era o modelo atômico de Thomson?
Falhas no modelo atômico de Rutherford
O átomo proposto por Rutherford não foi aceito imediatamente, muito por conta dos seus problemas de instabilidade. Segundo a teoria eletromagnética, uma carga elétrica acelerada irradia energia na forma radiação eletromagnética. A órbita circular faz com o que elétron apresente uma aceleração centrípeta, e, dessa forma, ele perde energia gradualmente, ficando cada vez mais lento. Assim, o elétron descreve uma trajetória espiral em direção ao núcleo atômico como consequência das forças de atração, fazendo com que o átomo entre em colapso.
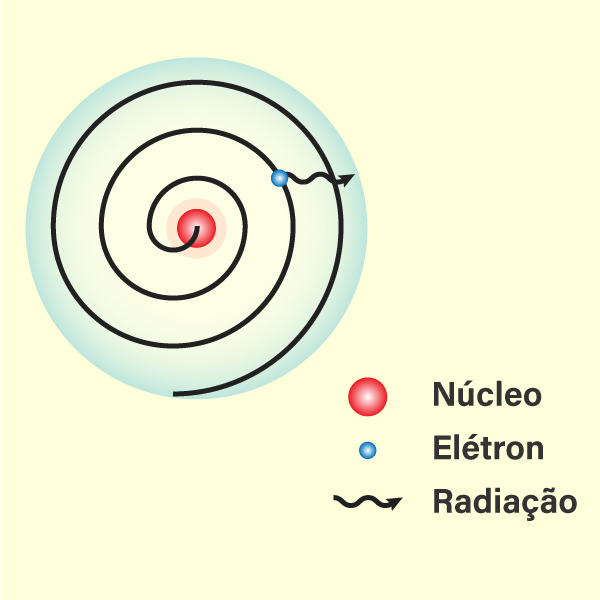
Apesar de ter proposto que os elétrons giravam em torno do núcleo em órbitas fixas, Rutherford não especificou essas órbitas nem o número de elétrons em cada órbita.
Qual a importância do modelo atômico de Rutherford
O átomo proposto por Rutherford, embora tenha sofrido com as questões relativas à instabilidade, trouxe importantes noções acerca da estrutura atômica. Graças ao seu experimento, Rutherford conseguiu comprovar que o átomo seria dividido em duas regiões, o núcleo e a eletrosfera. Além disso, conseguiu comprovar que o núcleo concentraria quase toda massa atômica, além de apresentar caráter positivo e ter cerca de 1/100.000 do tamanho total do átomo.
Seu modelo ainda serviu de inspiração para Niels Bohr, que foi aluno de Rutherford. Bohr foi capaz de corrigir as inconsistências do modelo atômico de Rutherford por meio de aplicação de mecânica quântica. Não à toa é comum alguns autores referenciarem o modelo como Rutherford-Bohr.
Veja também: Qual é o modelo atômico de Bohr?
Outros modelos atômicos
Além do modelo atômico de Rutherford, podem ser descritos os seguintes modelos atômicos:
- Modelo atômico de Dalton: desenvolvido pelo inglês John Dalton, no começo do século XIX, referenciava os átomos como “partículas últimas”, que seriam esferas rígidas, as quais não poderiam ser destruídas nem criadas.
- Modelo atômico de Thomson: desenvolvido pelo inglês Joseph John Thomson, no fim do século XIX, referencia os átomos como uma esfera de carga uniformemente positiva, com a presença de corpúsculos negativos, posteriormente chamados de elétrons.
- Modelo atômico de Bohr: desenvolvido pelo dinamarquês Niels Bohr, utiliza o modelo atômico de Rutherford como ponto de partida, mas introduzindo conceitos quânticos para explicá-lo. O átomo seria composto por um núcleo, denso e positivo, com órbitas estacionárias em torno do núcleo, nas quais ficariam os elétrons com energia constante, apesar de constantemente acelerados.
- Modelo atômico de Schrödinger: consequência dos estudos do austríaco Erwin Schrödinger na primeira metade do século XX, com base em novas descobertas acerca da matéria, como a dualidade onda-partícula e o princípio da incerteza. Por meio de suas descobertas, foi possível entender o comportamento das partículas dentro dos átomos, além de melhor descrever os orbitais atômicos e adicionar parâmetros relativos à repulsão entre os elétrons.
Também é possível citar o atomismo, a ideia filosófica que serviu de base para os modelos atômicos atuais. O atomismo foi desenvolvido inicialmente pelos filósofos gregos Leucipo e Demócrito, por volta do século V a.C. Segundo eles, o mundo material seria formado por infinitos entes minúsculos, os quais não poderiam ser criados, tampouco destruídos, recebendo o nome de “átomo”.
Acesse também: Como se deu a evolução dos modelos atômicos?
Exercícios resolvidos sobre o modelo atômico de Rutherford
Questão 1
(Unieva) Considere o seguinte experimento: um feixe de partículas alfa (núcleos de hélio) é disparado contra uma fina folha de ouro. A maioria das partículas alfa atravessa a folha sem desvio, mas algumas sofrem desvios significativos ou são refletidas de volta.
Com base nesse experimento e na teoria atômica atual, qual das seguintes afirmações é verdadeira?
A) Os átomos são maciços e indivisíveis.
B) O núcleo do átomo é pequeno e denso em comparação com o tamanho do átomo.
C) Os elétrons estão uniformemente distribuídos em todo o átomo.
D) Os prótons e os elétrons têm massas iguais.
Resolução:
Alternativa B.
O experimento em questão demonstrou a presença de um minúsculo corpo, porém de grande massa, no interior do átomo, capaz de ricochetear partículas alfa que foram disparadas contra ele. Assim, foi possível concluir que o átomo apresenta um núcleo pequeno e denso, porém com tamanho de cerca de 1/100.000 do átomo.
Questão 2
(Passe - UFMS) Leia o texto a seguir para responder à questão.
A Descoberta da Radioatividade
Quase todos já ouviram falar sobre a descoberta da radioatividade, que é um fenômeno pelo qual os núcleos atômicos sofrem transformações e emitem radiações, podendo, nesse processo, formar novos elementos químicos. Costuma-se dizer que esse fenômeno foi descoberto, acidentalmente, por Henri Becquerel, em 1896. Tudo aconteceu porque Becquerel guardou, em uma gaveta, um composto de urânio juntamente com uma chapa fotográfica, havendo depois revelado a chapa e notado nela os sinais da radiação.
(Fonte: https://www.if.ufrgs.br/tex/fis142/fism od/mod06/m_s02.html-Trecho do texto baseado no artigo de R.A. MARTINS, Como Becquerel não descobriu a radioatividade, publicado no Caderno Catarinense de Ensino de Física 7 (1990), 27-45). Acesso em: nov. 2019).
Com a descoberta da radioatividade, tornou-se possível conhecer partículas nucleares importantes, dentre elas, a partícula alfa. Um cientista utilizou essa partícula em um experimento laboratorial que levou à evolução do modelo atômico da época.
O nome desse cientista e de seu antecessor, cujo modelo atômico foi substituído em decorrência desse experimento, são, respectivamente:
A) Dalton e Thomson.
B) Thomson e Dalton.
C) Rutherford e Thomson.
D) Thomson e Rutherford.
E) Bohr e Rutherford.
Resolução:
Alternativa C.
O experimento relatado no texto foi proposto pelo cientista Ernest Rutherford. As conclusões trouxeram uma importante atualização para o modelo atômico, tornando obsoleto o modelo atômico anteriormente proposto por J. J. Thomson.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
TRETKOFF, E. May, 1911: Rutherford and the Discovery of the Atomic Nucleus. APS Advancing Physics. 1 mai. 2006. Disponível em: https://www.aps.org/apsnews/2006/05/rutherford-discovery-atomic-nucleus.
PODGORSAK, E. B. Rutherford-Bohr Atomic Model. In: Radiation Physics for Medical Physicists. 1a ed. p. 42-85. Berlim, Alemanha: Springer, 2006.