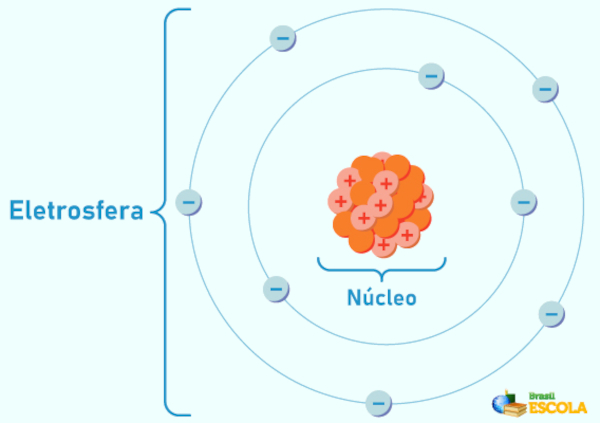
A estrutura atômica é formada pelas regiões importantes da composição do átomo, que é composto pelo núcleo atômico e pela eletrosfera. O núcleo de um átomo é denso e positivo, e nele estão presentes os prótons, de carga positiva, e os nêutrons, de carga neutra. Envolvendo o núcleo está a eletosfera, região em que estão presentes os elétrons, de carga negativa e massa muito inferior aos prótons e nêutrons.
Leia também: Afinal, o que é o átomo?
Tópicos deste artigo
- 1 - Resumo sobre estrutura atômica
- 2 - O que é a estrutura atômica?
- 3 - Quais são as partículas da estrutura atômica?
- 4 - Estrutura atômica e a Tabela Periódica
- 5 - História da estrutura atômica
- 6 - Curiosidades sobre a estrutura atômica
- 7 - Exercícios resolvidos sobre estrutura atômica
Resumo sobre estrutura atômica
-
A estrutura atômica é formada pelas regiões importantes da composição do átomo, que é composto por um núcleo, denso e positivo, envolto por uma região conhecida como eletrosfera.
-
No núcleo atômico estão os prótons, de carga positiva, e os nêutrons, sem carga.
-
Prótons e nêutrons possuem massa semelhante.
-
Na eletrosfera estão os elétrons, de carga negativa e com uma massa muito menor que a dos prótons e nêutrons.
-
A estrutura atômica tem grande relação com a Tabela Periódica, pois hoje já é sabido que as propriedades periódicas têm relação com a carga nuclear.
Não pare agora... Tem mais depois da publicidade ;) -
A estrutura atômica começou a ser elucidada no final do século XIX, por meio dos estudos de J. J. Thomson.
-
Hoje, a estrutura atômica é mais bem descrita por equações matemáticas desenvolvidas a partir da compreensão da mecânica quântica.
O que é a estrutura atômica?
A estrutura atômica é formada pelas regiões importantes da composição do átomo. Atualmente, entende-se que o átomo é composto por um núcleo, denso e positivo, envolto por uma região conhecida como eletrosfera.
Quais são as partículas da estrutura atômica?

A estrutura atômica possui duas regiões: o núcleo atômico e a eletrosfera. Saiba um pouco sobre cada uma delas e sobre suas partículas a seguir.
→ Núcleo atômico
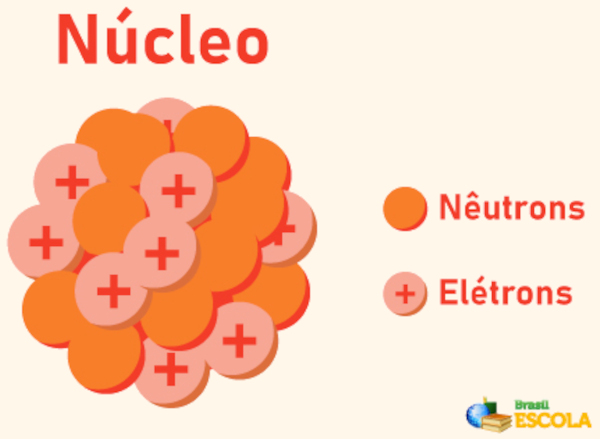
No núcleo atômico estão presentes os prótons, partículas de caráter positivo e com carga igual a +1. Sua massa, em unidades de massa atômica, é aproximadamente igual a 1,007 u, equivalente a, aproximadamente, 1,673 x 10−27 kg. Junto aos prótons estão os nêutrons, que não possuem carga (são neutros) e uma massa um pouco maior que a dos prótons, sendo aproximadamente 1,008 u, equivalente a, aproximadamente, 1,675 x 10−27 kg.
→ Eletrosfera
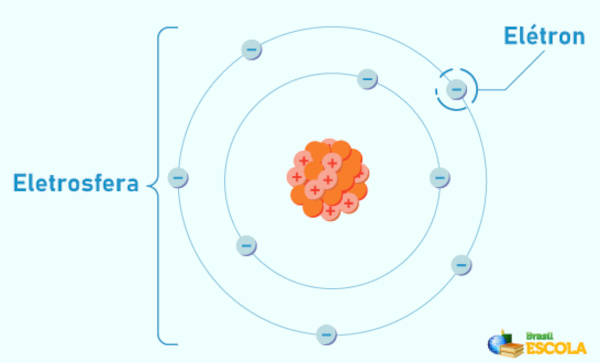
Na outra região do átomo, a eletrosfera, encontram-se os elétrons, com carga negativa, sendo igual a −1. Porém, a massa dos elétrons frente a prótons e nêutrons é desprezível, sendo próxima de 5,486 x 10−4 u, o que equivale a, aproximadamente, 9,109 x 10−31 kg.
Estrutura atômica e a Tabela Periódica
A estrutura atômica moderna tem relação direta com a periodicidade dos elementos químicos, ou seja, as similaridades das propriedades químicas e físicas entre elementos do mesmo grupo, bem como as mudanças graduais nas propriedades ao longo dos períodos. Embora na época da concepção da Tabela Periódica por Mendeleev em 1869 não houvessem as percepções modernas do átomo, hoje é sabido que a periodicidade dos elementos é consequência direta da estrutura atômica.
Os decaimentos radioativos de partículas alfa e beta, estudados a princípio por Ernest Rutherford e por Frederick Soddy, demonstraram que a massa não era a forma adequada de identificar elementos químicos. Soddy então percebeu um mesmo elemento químico pode ter átomos distintos (os chamados isótopos). Tudo se resolveu quando, em 1913, Henry Moseley conseguiu comprovar que seria a carga nuclear (hoje conhecida como número atômico) capaz de diferenciar os átomos e, assim, os elementos químicos. Dessa forma, a Tabela Periódica foi reajustada, colocando os elementos químicos em ordem crescente de número atômico (numericamente igual ao número de prótons). E, além disso, as propriedades dos elementos são funções periódicas de seus números atômicos, não de suas massas atômicas.
Se a organização da Tabela Periódica dependesse da massa, o potássio (K), com massa igual a 39,098 u, estaria na posição do elemento argônio (Ar), cuja massa é igual a 39,948 u. Não faria o mínimo sentido colocar no mesmo grupo um elemento extremamente reativo como o potássio e elementos inertes ou muito pouco reativos, que são os gases nobres.
História da estrutura atômica
A estrutura atômica começou a ser elucidada a partir de J. J. Thomson, no final do século XIX. É verdade que John Dalton já havia, a essa época, apresentado sua interpretação corpuscular dos gases constituintes da atmosfera, caracterizando-se o primeiro modelo científico do átomo. Contudo, Dalton ainda tinha a percepção de que os átomos seriam a menor partícula possível da matéria, não fazendo qualquer menção a sua estrutura.
Em 1830, Michael Faraday mostrou que, ao se passar uma corrente elétrica por uma solução eletrolítica, reações químicas ocorreriam nos eletrodos, com liberação ou deposição de matéria neles. Estava ali criada a eletrólise e o ponto de partida da natureza corpuscular da eletricidade.
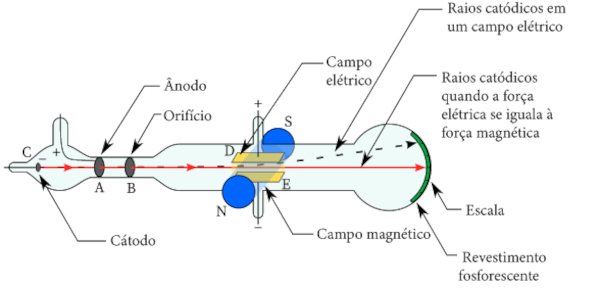
Na segunda metade do século XIX, diversos cientistas, inclusive Faraday, começaram a aplicar descargas elétricas em gases rarefeitos, ou seja, em condições de quase vácuo, em um instrumento conhecido como ampola de Crookes. Ao realizar tal procedimento, percebia-se a formação de um feixe luminoso oriundo do eletrodo negativo (cátodo) da ampola de Crookes, e, assim, tal feixe foi chamado de “raio catódico”.
Com o auxílio de materiais fluorescentes e fosforescentes acoplados à extremidade da ampola, percebeu-se que tais raios trafegavam em trajetória retilínea e, sob ação de um campo elétrico ou magnético, demonstravam possuir carga negativa. Também foi percebido que as características dos raios catódicos eram as mesmas, independentemente da natureza dos eletrodos ou da composição do gás utilizado.
Foi a partir daí que J. J. Thomson, em 1897, não só percebeu a natureza corpuscular dos raios catódicos (ou seja, eles eram feitos de pequenas partículas) como também mensurou a relação entre a carga elétrica e a massa deles. Como a relação era a mesma, independetemente do gás utilizado, Thomson concluiu que tais corpúsculos deveriam fazer parte da estrutura atômica e, posteriormente, deu a eles o nome de elétrons.
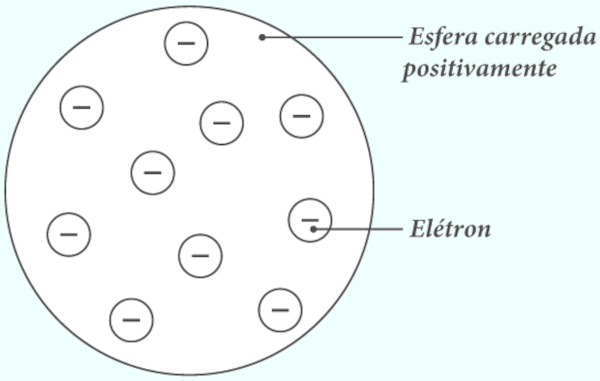
Thomson publicou, então, em 1904, um artigo sobre a estrutura atômica (“On the structure of atom: an investigation of the stability and periods of oscillation of a number of corpuscles arranged at equal intervals around the circumference of a circle; with application of the results to the theory of atomic structure”) na revista Philosophical Magazine, descrevendo que os átomos consistiam em um número de corpúsculos eletricamente negativos englobados numa esfera uniformemente positiva.
Apesar de não descrever constituintes positivos para o átomo, Thomson afirmava que os elétrons ligados circulavam em anéis coplanares dentro de uma esfera positiva. Estava aí fundamentada a primeira percepção da estrutura atômica, pondo fim à noção de que o átomo era uma partícula indivisível.
O final do século XIX também trouxe a descoberta dos raios X, em 1895, por Wilhelm Röntgen. Meses depois, o francês Henry Becquerel observou, pela primeira vez, a radioatividade natural. Esse novo campo de estudo seria essecial para o avanço na compreensão da estrutura atômica. Foi Ernest Rutherford quem descobriu que a emissão radioativa era composta de três tipos majoritários: alfa (com carga +2 e massa igual a 4), beta (idêntica a elétrons acelerados) e raios gama (sem massa e que seriam radiações eletromagnéticas).
À esta altura, já se sabia que partículas beta poderiam ser espalhadas após colisão com um bloco metálico, mas ninguém sabia que as partículas alfa também poderiam. Diante disso, em 1909, Ernest Rutherford determinou que seu aluno Ernest Mardsen realizasse um experimento, que consistia em estudar esse comportamento das partículas alfa. Mardsen não só comprovou que um bloco de metal era capaz de espalhar as partículas alfa como também uma fina folha de ouro, algo tão inesperado que fez Rutherford declarar que seria semelhante a “atirar um projétil naval de 15 polegadas contra um pedaço de papel e ele voltar e atingir você”, além de dizer que esse teria sido o momento mais incrível de toda sua vida.
A partir daí, Rutherford concluiu que haveria uma mínima região do átomo que concentraria praticamente toda a massa dele e que seria carregada positivamente, algo que posteriormente foi determinado por ele como o núcleo atômico. Com isso, a estrutura atômica foi atualizada: um núcleo denso e positivo, cujo tamanho seria ínfimo em relação ao comprimento total do átomo, com os elétrons orbitando tal núcleo, muito semelhante aos planetas orbitando o sol. Apenas dez anos depois, em 1919, é que Rutherford comprovou que os núcleos atômicos seriam compostos por partículas positivas, os chamados prótons.
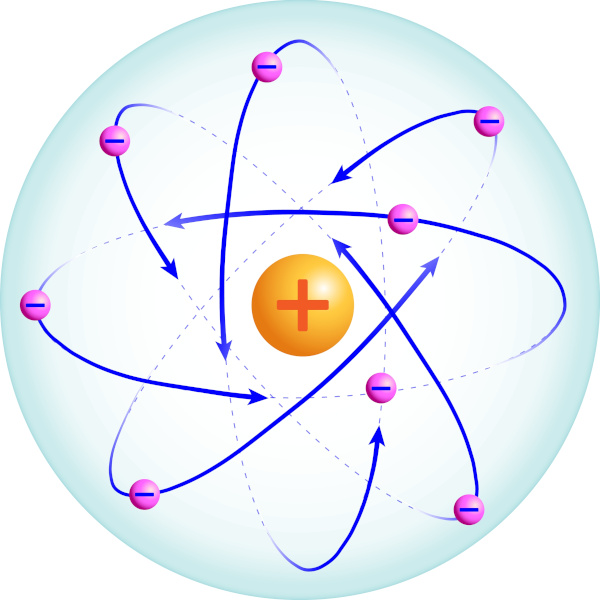
Entre o experimento de Rutherford e Mardsen e a descoberta dos prótons, um aluno de Rutherford, conhecido como Niels Bohr, atualizou a estrutura atômica baseado na recém-desenvolvida mecânica quântica e também na espectroscopia. Se o átomo fosse como Rutherford previa, ele não seria estável, uma vez que os elétrons, pela teoria clássica da eletromagnética, perderiam energia ao circular o núcleo, descrevendo uma rota que ocasionaria na sua colisão com o núcleo. Sendo assim, o átomo de Rutherford teve pouco tempo de vida e existência.
Bohr então estabeleceu a quantização da energia dos elétrons; eles estariam em camadas fixas, conhecidas como órbitas ou estados fundamentais (ou ainda estacionários). Enquanto os elétrons estivesse nessas órbitas, eles não absorveriam ou emitiriam energia, mantendo sua energia total constante. Bohr ainda desenvolveu expressões matemáticas não só para a energia do átomo, mas também para seu raio. Todos os cálculos de Bohr estavam de acordo com os dados experimentais obtidos das linhas espectrais do átomo de hidrogênio.
Contudo, embora o modelo de Bohr tenha sido revolucionário, ele foi atropelado pelas constantes descobertas e expansão da mecânica quântica. Mesmo com as adaptações de Arnold Sommerfeld, em 1916, os avanços no campo demonstraram que o modelo atômico proposto por Bohr só seria válido para átomos monoeletrônicos, ou seja, hidrogênio e espécies isoeletrônicas, uma vez que a matemática proposta por Bohr não previa os efeitos causados pela presença de dois ou mais elétrons na estrutura.
O modelo atômico sofreu significantes alterações ainda na primeira metade do século XX. Rutherford, ao descobrir o próton, já havia proposto a existência de uma partícula de massa semelhante ao próton, mas sem carga. Tais partículas tiveram sua existência comprovada apenas em 1932, pelo cientista James Chadwick, ao perceber a emissão delas ao bombardear uma folha de berílio com partículas alfa. Chadwick as denominou nêutrons.
Atualmente o átomo é descrito por meio de modelos quânticos, consequência de descobertas como a dualidade onda-partícula do elétron (por Louis de Broglie, em 1925) e o princípio da incerteza (por Werner Heisenberg, em 1927). O movimento dos elétrons então foi substituído por uma função de onda, cuja base matemática foi proposta por Erwin Schrödinger. Esse trabalho foi essencial para justificar a energia dos átomos e dos elétrons, resolvendo o problema de Bohr em não conseguir descrever níveis eletrônicos para átomos polieletrônicos.
Curiosidades sobre a estrutura atômica
-
Thomson, em seus escritos, não utiliza a palavra “pudim de passas” para descrever a estrutura de seu átomo. Essa é uma analogia trazida por livros didáticos de Química.
-
Em 1904, no mesmo ano e na mesma revista em que Thomson publicou seu artigo, Hantaro Nagaoka, um físico japonês, propôs que o átomo seria composto por um caroço central rodeado por anéis constituídos por partículas que giravam com mesma velocidade angular, tal qual o planeta Saturno. Tal descrição é muito próxima da que foi proposta por Ernest Rutherford posteriormente.
-
Prótons e nêutrons são constituidos por partículas ainda menores, os quarks.
-
Os quarks presentes nos prótons e nêutrons criam uma força atrativa maior que a força repulsiva, chamada de força forte, que permite a manutenção do núcleo atômico.
Exercícios resolvidos sobre estrutura atômica
Questão 1
(Udesc) As investigações sobre a estrutura da matéria representam um importante marco na história da química, especialmente nos séculos XIX e XX, em que foi proposta a existência de várias partículas que podem ser encontradas em um átomo.
Sobre essas partículas, analise as proposições.
I. Os prótons são partículas de carga positiva que estão localizadas no núcleo do átomo.
II. Os elétrons são partículas de carga negativa que estão localizadas na eletrosfera.
III. Os nêutrons são partículas sem carga elétrica e estão localizadas na eletrosfera.
IV. Os prótons possuem massa maior que a dos elétrons.
V. Os nêutrons estão localizados no núcleo do átomo e possuem massa equivalente à massa dos elétrons.
VI. Os prótons e os elétrons são partículas que, embora possuam cargas opostas, estão localizadas no núcleo atômico.
Assinale a alternativa correta.
A) Somente as afirmativas I, II e III são verdadeiras.
B) Somente as afirmativas II, IV e V são verdadeiras.
C) Somente as afirmativas V e VI são verdadeiras.
D) Somente as afirmativas III e VI são verdadeiras.
E) Somente as afirmativas I, II e IV são verdadeiras.
Resolução:
Alternativa E.
As afirmativas III, V e VI estão erradas, pois os nêutrons não se encontram na eletrosfera, mas no núcleo; os nêutrons não possuem massa equivalente à massa dos elétrons, mas sim dos prótons; os elétrons, diferentemente dos prótons, não se encontram no núcleo atômico, mas sim na eletrosfera.
Questão 2
(Enem) No final do século XIX, muitos cientistas estavam interessados nos intrigantes fenômenos observados nas ampolas de raios catódicos, que são tubos sob vácuo em que se ligam duas placas a uma fonte de alta tensão. Os raios catódicos passam através de um orifício no ânodo e continuam o percurso até a outra extremidade do tubo, onde são detectados pela fluorescência produzida ao se chocarem com um revestimento especial, como pode ser observado na figura. Medições da razão entre a carga e a massa dos constituintes dos raios catódicos mostram que a sua identidade independe do material do cátodo ou do gás dentro das ampolas.
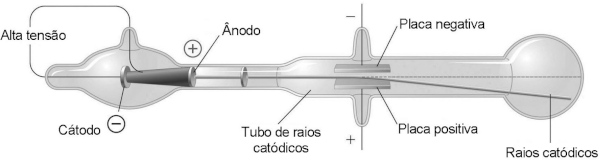
CHANG, R.; GOLDSBY, K. A. Química. Porto Alegre: Bookman, 2013 (adaptado).
Essa radiação invisível detectada nas ampolas é constituída por
A) ânions.
B) cátions.
C) prótons.
D) elétrons.
E) partículas alfa.
Resolução:
Alternativa D.
A questão descreve uma ampola de Crookes, que permitiu a descoberta dos raios catódicos. Tal fenômeno permitiu que J. J. Thomson descobrisse a existência do elétron.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Princípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
BENEDETTI FILHO, E.; MATSUMOTO, M. Y. Hantaro Nagaoka e o modelo saturniano. Química Nova Na Escola, v. 44, n. 1, p. 9-16, fev. 2022.
CAMPBELL, J. Rutherford, transmutation and the proton. CERN Courier, 8 mai. 2019. Disponível em: https://cerncourier.com/a/rutherford-transmutation-and-the-proton/.
CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
EPIOTIS, N. D.; HENZE, D. K. Periodic Table (Chemistry). Encyclopedia of Physical Science and Technology. p. 671-695. 3ª ed. Cambridge, EUA: Academic Press, 2003.
LOPES, C. V. M.; MARTINS, R. A. J. J. Thomson e o uso de analogias para explicar os modelos atômicos: o “pudim de passas” nos livros texto. Encontro Nacional de Pesquisa em Educação em Ciências. 8 nov. 2009.
NCERT. STRUCTURE OF ATOM. Disponível em: https://ncert.nic.in/ncerts/l/kech102.pdf.