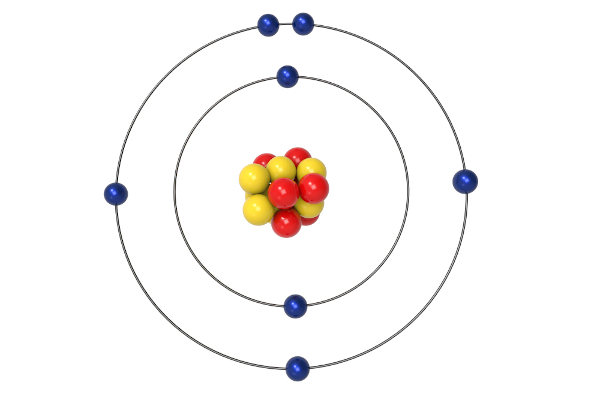
O modelo atômico de Bohr, desenvolvido pelo físico dinamarquês Niels Bohr e apresentado em 1913, marca a primeira vez que um modelo atômico foi construído a partir de pressupostos quânticos. Dessa forma, o modelo de Bohr marcou a separação quanto às teorias clássicas, abrindo caminho para uma compreensão do átomo de uma forma mais moderna, embasada nos trabalhos de Max Planck, Johann Balmer e também no modelo planetário de Ernest Rutherford.
Esse modelo introduziu conceitos importantes, como os estados estacionários, além das órbitas eletrônicas, locais onde os elétrons não absorveriam ou emitiriam energia. Porém, o modelo de Bohr só é aplicável aos átomos monoeletrônicos — um único elétron —, o que o levou a ser suplantado por teorias mais modernas, trazidas pela mecânica quântica do físico alemão Werner Heisenberg e do matemático austríaco Erwin Schrödinger. Contudo, a contribuição de Bohr para a compreensão da matéria é indubitável, sendo seu trabalho uma das maiores publicações científicas da história.
Leia também: Atomística — o estudo do átomo
Tópicos deste artigo
- 1 - Resumo sobre o modelo atômico de Bohr
- 2 - Videoaula sobre o modelo atômico de Bohr
- 3 - Características do modelo atômico de Bohr
- 4 - Postulados de Bohr
- 5 - Base experimental do modelo atômico de Bohr
- 6 - Limitações do modelo atômico de Bohr
- 7 - Exercícios resolvidos sobre o modelo atômico de Bohr
Resumo sobre o modelo atômico de Bohr
-
Foi desenvolvido em 1913, pelo dinamarquês Niels Bohr.
-
É o primeiro modelo atômico que utiliza noções da recém-descoberta mecânica quântica.
-
Resolve os problemas de instabilidade do modelo atômico de Rutherford.
-
Indica que elétrons estão em camadas quantizadas e, enquanto nessas camadas, podem se movimentar sem perder energia.
-
Define transição eletrônica.
-
Tem sua base experimental na espectroscopia.
-
É limitado para átomos hidrogenoides.
Videoaula sobre o modelo atômico de Bohr
Características do modelo atômico de Bohr
O modelo atômico de Rutherford possuía um embasamento experimental que deixava poucas dúvidas acerca de sua validade. Contudo, questões relacionadas à estabilidade do átomo nuclear proposto pelo neozelandês começaram a surgir. Por exemplo, de acordo com a teoria eletromagnética clássica, embasada pelo teorema do físico irlandês Joseph Larmor, os elétrons, se circulando em órbitas no entorno do núcleo, deveriam perder energia e assim descreveriam uma trajetória espiral ao encontro do núcleo, colidindo com este, resultando em seu colapso.
Os cálculos descritos a partir do teorema de Larmor, inclusive, mostravam que era impossível a existência do átomo de hidrogênio por um tempo maior que, aproximadamente, 1,6 x 10-11 segundos.
Nesse contexto e baseado na espectroscopia, uma técnica que utiliza radiação para a obtenção de informações da estrutura e composição da matéria, o dinamarquês Niels Bohr estabeleceu, em seu átomo, que os elétrons estariam dispostos, na verdade, em órbitas eletrônicas. Essa ideia resolvia o problema da estabilidade de Rutherford, pois, segundo Bohr, enquanto nessas órbitas (chamadas de estados estacionários ou fundamentais), os elétrons não absorveriam ou emitiriam energia, ou seja, sua energia total seria constante.
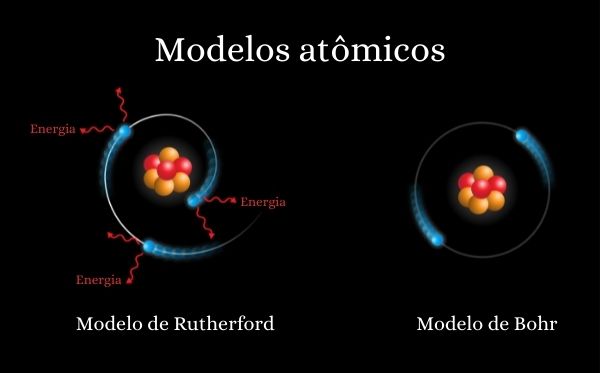
Segundo Bohr, essas órbitas eletrônicas e o comportamento dos elétrons presentes nelas não poderiam ser explicadas apenas pelas leis da mecânica clássica, mas também pelas recentes teorias quânticas, desenvolvidas principalmente por Max Planck.
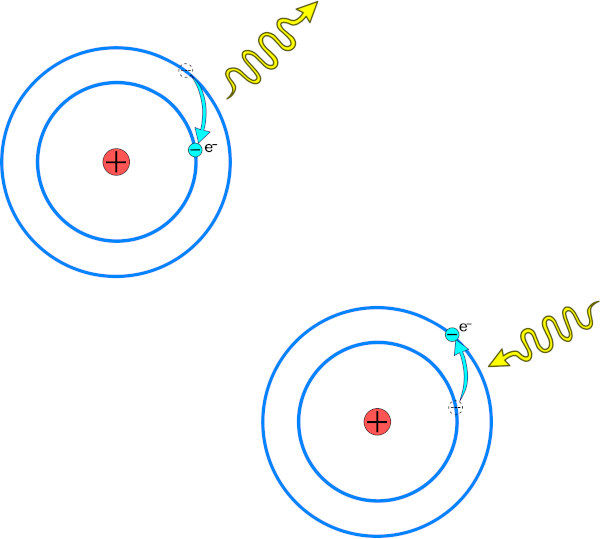
As órbitas eletrônicas, também conhecidas como camadas eletrônicas, seriam mais energéticas conforme mais distantes do núcleo. Um elétron poderia passar (saltar) para uma órbita mais energética, contudo, ao fazer isso, o elétron deveria absorver energia. Ao retornar ao seu estado estacionário, o elétron então deveria emitir radiação eletromagnética, de acordo com os preceitos estabelecidos pela teoria de Max Planck. Esse efeito é conhecido como transição eletrônica.
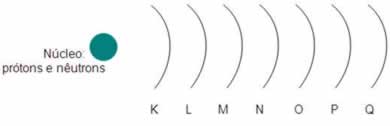
Posteriormente, as camadas eletrônicas do átomo de Bohr receberam letras para identificá-las. Ao todo, como são 118 elementos na Tabela Periódica, sete camadas eletrônicas são descritas. Elas são representadas pelas letras K, L, M, N, O, P e Q, sendo K a camada mais interna, de menor energia, e Q a camada mais externa, de maior energia.
O número de elétrons por camada eletrônica é dado empiricamente como:
|
Camada |
Número máximo de elétrons |
|
K |
2 |
|
L |
8 |
|
M |
18 |
|
N |
32 |
|
O |
32 |
|
P |
18 |
|
Q |
8 |
Leia também: Física moderna — as descobertas sobre o mundo quântico que revolucionaram a ciência
Postulados de Bohr
O modelo de Bohr é fundamentado em postulados específicos, os quais podem ser entendidos como:
-
O equilíbrio dinâmico dos sistemas atômicos, ou seja, o movimento circular do elétron em torno do núcleo, bem como a atração de natureza elétrica entre estes, obedecem às leis da mecânica clássica.
-
Os elétrons estão dispostos em órbitas circulares específicas, em que estes apresentam um momento angular cujo valor sempre será um múltiplo inteiro do número h/2π, sendo h a Constante de Planck. Isso determina que nem todas as órbitas para os elétrons são possíveis, apenas as que são múltiplas do valor anteriormente citado, o que não era previsto na mecânica clássica, em que todas as órbitas seriam possíveis.
-
Apesar de constantemente acelerados, elétrons, quando nessas órbitas circulares (ou órbitas eletrônicas) possíveis, apresentam energia total constante, sem emissão de energia ou radiação eletromagnética.
-
Um elétron, ao absorver energia, salta para uma órbita eletrônica mais externa (mais energética). Ao saltar para uma órbita mais interna, ele emite energia na forma de radiação eletromagnética.
Base experimental do modelo atômico de Bohr
O modelo atômico de Bohr é, provavelmente, o primeiro contato dos estudantes com teorias modernas de física e química. Sua base experimental advém da espectroscopia, uma técnica que tem como fundamento revelar o efeito da interação da radiação (como a luz) com a matéria, estando esta no estado sólido, líquido ou gasoso.
Quando um feixe de luz é propagado por uma fenda estreita e depois decomposto por um prisma (tal como Isaac Newton), ele gera o espectro da luz visível, que é o intervalo de comprimentos de onda capazes de serem enxergados por nós, seres humanos.

Em 1802, William Wollaston observou a presença de linhas escuras no espectro gerado pela luz solar, as quais foram amplamente estudadas por Joseph von Fraunhofer, posteriormente. Robert Bunsen e Gustav Kirchhoff conseguiram constatar que cada elemento estava associado a um espectro particular, o que quer dizer que os espectros podiam ser utilizados para identificar e diferenciar elementos químicos, abrindo espaço para a determinação da composição química do Sol e de outros astros.
Quando um gás é aquecido em altas temperaturas ou sofre descarga elétrica, percebe-se uma emissão de luz. Essa luz, em um espectroscópio, gera uma série de linhas distintas, as quais são chamadas de bandas de radiação, com frequências (ou comprimentos de onda) variadas. Por exemplo, podia-se colocar gás hidrogênio nessas condições e assim se obter um espectro específico para esse elemento, com bandas em comprimentos de onda específicos, como é possível perceber na imagem a seguir.
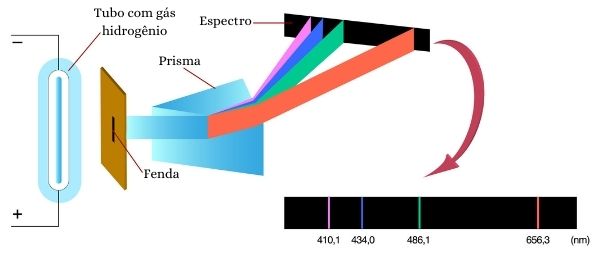
Ou seja, cada elemento tinha o seu próprio espectro, sendo uma excelente técnica para identificação da composição química, uma vez que só era necessária a luz emitida. Veja, a seguir, espectros do hidrogênio, mercúrio e neônio.
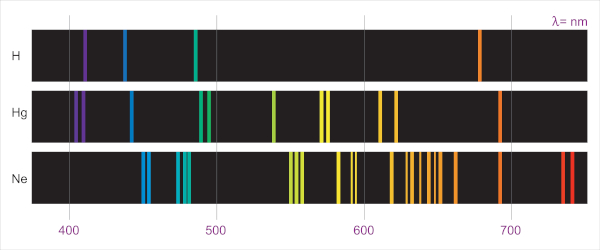
Isso serviu para resolver a questão das linhas escuras no espectro da luz solar, pois as elas eram, na verdade, referentes aos elementos que compunham o Sol. Assim, bastou associar os espectros dos elementos conhecidos com o obtido para o Sol e para saber composição do mesmo.
Niels Bohr então associou o espectro de hidrogênio à estrutura do átomo de hidrogênio. De forma simples, Bohr afirmou que as linhas de cores do espectro de hidrogênio eram resultantes do movimento dos elétrons entre as camadas, ou seja, fruto da transição eletrônica entre as camadas. Afinal, ao retornar ao estado fundamental, o elétron emite radiação na forma de luz (cor).
As linhas espectrais podiam então ser associadas às camadas eletrônicas do átomo, e a energia para que um elétron pudesse transicionar de uma camada para outra era proporcional ao número de onda de cada linha espectral. Essa energia para que o elétron saltasse de um nível para o outro foi calculada por Bohr, através de uma equação baseada nos trabalhos de Johannes Rydberg e Johann Balmer. Com isso, Bohr conseguiu calcular os níveis de energia para o átomo de hidrogênio com boa precisão.
Confira no nosso podcast: A revolução da computação quântica
Limitações do modelo atômico de Bohr
Embora revolucionário, o modelo de Bohr foi rapidamente superado pela avalanche de descobertas trazidas pela maior compreensão da mecânica quântica. Arnold Sommerfeld, em 1916, fez adequações ao modelo atômico de Bohr, propondo que o movimento dos elétrons no átomo de hidrogênio seriam elípticos. Isso porque, com a melhora na resolução das imagens obtidas na espectroscopia, as linhas espectrais do espectro de hidrogênio se mostraram, na verdade, um conjunto de linhas finas. Como consequência, demonstrou-se que aquilo que se imaginava ser um único estado de energia eram, na verdade, vários estados de energia muito próximos, os chamados subníveis de energia.
Outro ponto limitante é que o trabalho de Bohr se aplica apenas para átomos que contêm apenas um elétron, como H, He+, Li2+ etc., por conta dos efeitos originados quando há pelo menos dois elétrons na estrutura.
Exercícios resolvidos sobre o modelo atômico de Bohr
Questão 1
(PUC-MG 2007) Os interruptores brilham no escuro graças a uma substância chamada sulfeto de zinco (ZnS), que tem a propriedade de emitir um brilho amarelo-esverdeado depois de exposta à luz. O sulfeto de zinco é um composto fosforescente. Ao absorverem partículas luminosas, os elétrons são estimulados e afastados para longe do núcleo. Quando você desliga o interruptor, o estímulo acaba e os elétrons retornam, aos poucos, para seus lugares de origem, liberando o seu excesso de energia na forma de fótons. Daí a luminescência.
(Texto adaptado do artigo de aplicações da fluorescência e fosforescência, de Daniela Freitas)
A partir das informações do texto, pode-se concluir que o melhor modelo atômico que representa o funcionamento dos interruptores no escuro é o de:
a) Rutherford
b) Bohr
c) Thomson
d) Heisenberg
Resposta:
O texto fala sobre emissão de luz a partir de transição eletrônica, ou seja, saltos de elétrons entre camadas. O modelo atômico capaz de explicar tal fenômeno é o de Bohr, referido na letra B.
Questão 2
(Unirg-TO 2014 — modificada) Os modelos atômicos foram desenvolvidos em teorias fundamentadas na experimentação por diferentes cientistas, incluindo John Dalton, J.J. Thomson, Ernest Rutherford e Niels Bohr. Em 2013, a teoria do modelo atômico de Niels Bohr completou 100 anos. Essa teoria descreve o átomo como:
a) um núcleo pequeno, carregado positivamente, cercado por elétrons em órbitas quantizadas.
b) uma esfera positiva contendo elétrons distribuídos uniformemente.
c) uma minúscula esfera maciça, impenetrável, indestrutível, indivisível e sem carga.
d) um modelo planetário, no qual os elétrons descrevem um movimento circular ao redor do núcleo.
e) um núcleo pequeno, carregado negativamente, cercado por elétrons em órbitas quantizadas.
Resposta:
A teoria de Bohr explica que os elétrons estão em órbitas específicas em torno do núcleo atômico, que é positivo, e nessas órbitas (chamadas de fundamentais) os elétrons se movimentariam sem perder energia. Ocorre que essas órbitas são quantizadas, ou seja, obedecem a um valor específico e calculado, não podendo o elétron ficar em qualquer região em torno do núcleo.
Assim, a que melhor descreve o modelo de Bohr é a alternativa A.
Por Stéfano Araújo Novais
Professor de Química