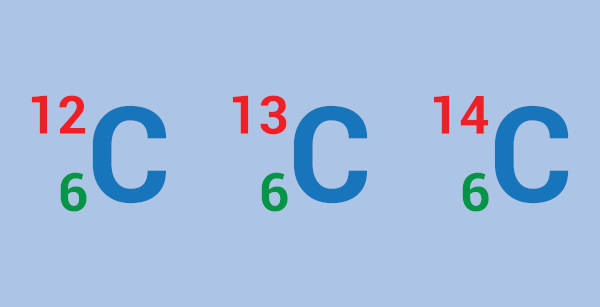Os isótopos são nuclídeos que possuem o mesmo número atômico (número de prótons), mas diferentes números de massa (diferem nos nêutrons). O termo isótopo significa “o mesmo lugar” e vem do grego.
Os isótopos podem ser classificados de duas formas: naturais ou sintéticos (artificiais), estáveis ou instáveis (radioisótopos). Além disso, não podem ser confundidos com isóbaros e isótonos, pois os isóbaros possuem mesma massa, mas número de prótons diferente, enquanto os isótonos possuem mesmo número de nêutrons e diferem no número atômico. Existem 339 isótopos naturais, sendo 250 estáveis. Os artificiais já superam o número de 3000.
Leia também: Partes que compõem a estrutura do átomo
Tópicos deste artigo
- 1 - Resumo sobre os isótopos
- 2 - O que são isótopos?
- 3 - Quais são os tipos de isótopos?
- 4 - Nomenclatura dos isótopos
- 5 - Diferenças entre isótopos, isóbaros e isótonos
- 6 - Tabela dos isótopos
- 7 - Exercícios resolvidos sobre isótopos
Resumo sobre os isótopos
- Os isótopos são átomos que possuem o mesmo número de prótons (número atômico), mas diferentes números de massa (números de nêutrons diferentes).
- A palavra isótopo deriva do grego e significa “o mesmo lugar”.
- Os isótopos podem ser classificados entre naturais e sintéticos (ou artificiais), assim como entre estáveis e instáveis.
- Os isótopos instáveis sofrem decaimento radioativo e, por isso, são chamados de radioisótopos.
- Existem 339 isótopos naturais, sendo 250 estáveis. O número de isótopos sintéticos já ultrapassa o número de 3000.
O que são isótopos?
Segundo a União Internacional de Química Pura e Aplicada (Iupac), isótopos são nuclídeos (espécies atômicas) que possuem o mesmo número atômico (número de prótons), mas diferentes números de massa. O termo “isótopo” deriva do grego e significa “o mesmo lugar”.
Dessa definição podemos perceber que os isótopos variam o número de nêutrons entre si, pois os elétrons possuem massa desprezível frente aos prótons e nêutrons. Além disso, os átomos são espécies eletricamente neutras; logo, o número de prótons tem que ser igual ao número de elétrons.
Quais são os tipos de isótopos?
Uma classificação possível para os isótopos é separá-los em termos de isótopos naturais ou sintéticos (ou artificiais).
Os naturais, como o nome vem a dizer, são aqueles que podem ser encontrados na natureza, ou seja, em alguma parte de nosso planeta, sem a necessidade de intervenção em laboratório para sua produção. Apenas os isótopos naturais são levados em consideração para o cálculo da massa atômica. Já os isótopos sintéticos (ou artificiais) não são encontrados em nosso planeta, havendo necessidade de produção em laboratório, mediante reações nucleares (como fissão ou fusão nucleares).
Outra forma de classificar os isótopos é por meio da separação entre estáveis e instáveis. Os isótopos estáveis são aqueles que mantêm sua estrutura atômica ao longo do tempo, sem sofrer decaimento radioativo e sem emissão de radiação. Já os isótopos instáveis, pelo contrário, emitem radiação e sofrem reações de decaimento, transmutando-se para um novo isótopo ou para um nuclídeo de outro elemento. Os isótopos instáveis também podem ser chamados de radioativos ou radioisótopos.
Nomenclatura dos isótopos
Como a diferença entre os isótopos se dá no número de massa, é comum diferenciá-los justamente por essa grandeza. Por isso, a Iupac permite a utilização do nome do elemento químico, precedido do seu número de massa.
Por exemplo, o oxigênio possui três isótopos: um de massa 16 (16O), outro de massa 17 (17O) e outro de massa 18 (18O). A nomenclatura oficial é simples, sendo “oxigênio-18” para o isótopo de massa 18, por exemplo.
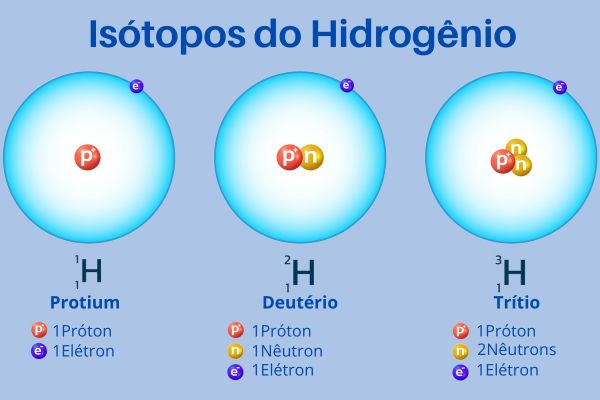
O hidrogênio é a única exceção, pois seus três isótopos — 1H, 2H e 3H — podem receber, respectivamente, os nomes prótio, deutério e trítio. Aliás, também se permite trocar o símbolo “H” do hidrogênio para “D” no caso do deutério e “T” no caso do trítio, embora isso não seja muito recomendado pela Iupac, já que pode causar confusão na compreensão de alguma fórmula. As formas iônicas dos isótopos também podem receber variações de nome, sendo 1H+ chamado de próton, 2H+ como dêuteron e 3H+ como tríton.
Diferenças entre isótopos, isóbaros e isótonos
- Isótopos: como já dito, são nuclídeos que possuem mesmo número atômico, mas diferente número de massa.
- Isóbaros: segundo a Iupac, são nuclídeos que possuem o mesmo número de massa.
- Isótonos: também segundo a Iupac, são nuclídeos que possuem o mesmo número de nêutrons, mas diferente número atômico.
Assim sendo, não há como o nuclídeo ser isótopo, isóbaro e isótono de outro nuclídeo ao mesmo tempo.
-
Videoaula sobre isótopos, isóbaros, isótonos e isoeletrônicos
Tabela dos isótopos
O número de isótopos naturais conhecidos até então é de 339. Desses, 250 podem ser considerados estáveis. A estimativa de isótopos sintéticos, entretanto, é de mais de 3000.
A seguir estão listados os isótopos naturais dos dez elementos químicos mais abundantes na crosta terrestre:
|
Elemento |
Isótopos naturais |
|
Oxigênio |
16O; 17O; 18O |
|
Silício |
28Si; 29Si; 30Si |
|
Alumínio |
27Al |
|
Ferro |
54Fe; 56Fe; 57Fe; 58Fe |
|
Cálcio |
40Ca; 42Ca; 43Ca; 44Ca; 46Ca; 48Ca |
|
Sódio |
23Na |
|
Magnésio |
24Mg; 25Mg; 26Mg |
|
Titânio |
46Ti; 47Ti; 48Ti; 49Ti; 50Ti |
|
Hidrogênio |
1H; 2H |
Leia também: Eletrosfera — um estudo sobre a região do átomo onde estão os elétrons
Exercícios resolvidos sobre isótopos
Questão 1
(Urca 2023) Marque a alternativa que contenha a informação correta.
a) Isóbaros são átomos de elementos diferentes que apresentam a mesma configuração eletrônica.
b) Isótonos são átomos de elementos diferentes que apresentam o mesmo conjunto de números quânticos.
c) Isótopos são átomos de elementos diferentes que possuem o mesmo número atômico.
d) Isótopos são átomos de um mesmo elemento químico que possuem o mesmo número de prótons.
e) Isóbaros são átomos de elementos químicos diferentes que apresentam mesmo raio atômico.
Resposta: Letra D.
Um elemento químico é definido como um conjunto de átomos com mesmo número atômico. Os isótopos, como possuem mesmo número de prótons e, por esse motivo, o mesmo número atômico, são todos átomos de um mesmo elemento químico.
Questão 2
(PUC-RJ/2020) Sabe-se que 12C e o 13C são isótopos e, por causa disso,
a) têm propriedades químicas muito diferentes.
b) possuem o mesmo número de nêutrons.
c) são elementos diferentes.
d) possuem o mesmo número de prótons.
e) estão em posições diferentes na Tabela Periódica dos elementos.
Resposta: Letra D. Se as espécies 12C e 13C são isótopos; logo, possuirão o mesmo número de prótons.
Fontes:
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY – IUPAC. Glossary of terms used in physical organic chemistry. Pure and Applied Chemistry, Reino Unido, 1994.
COMISSION ON ISOTOPIC ABUNDANCES AND ATOMIC WEIGHTS. Isotopic Abundances. Disponível em: . Acesso em 30 jan. 2024.
HAYNES, W. M. (ed.) CRC Handbook of Chemistry and Physics. 95a ed. CRC Press: 2014.
INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY. Nomenclature of Inorganic Chemistry: IUPAC Recommendations 2005. RSC Publishing: Londres, 2005.