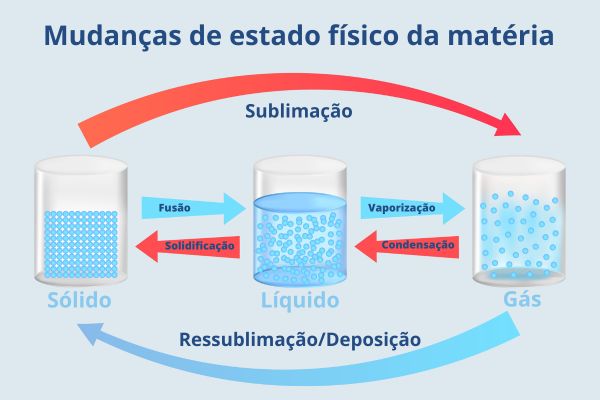
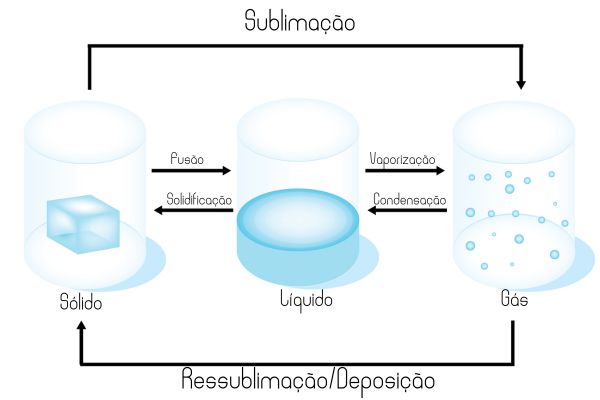
As mudanças de estado físico da matéria são processos físicos de passagem de um estado de agregação para outro. São elas:
- fusão;
- vaporização;
- condensação;
- solidificação;
- sublimação;
- ressublimação/deposição.
Leia também: Quais são as propriedades da matéria?
Tópicos deste artigo
- 1 - Resumo sobre as mudanças de estado físico da matéria
- 2 - Videoaula sobre mudanças de estado físico da matéria
- 3 - Quais são os tipos de mudança de estado físico da matéria?
- 4 - Fatores que influenciam as mudanças de estado físico da matéria
- 5 - Gráficos de mudanças de estado físico
- 6 - Diagrama de fases
- 7 - Exercícios resolvidos sobre as mudanças de estado físico da matéria
Resumo sobre as mudanças de estado físico da matéria
- As mudanças de estado físico da matéria são processos de passagem de um estado de agregação para outro.
- São elas a fusão, a vaporização, a condensação, a solidificação, a sublimação e a ressublimação/deposição.
- Durante uma mudança de estado físico, as interações entre as partículas são rompidas ou formadas, dando origem a estados mais ou menos agregados.
- Essas mudanças são influenciadas não só pelas interações como também pela pressão e pela composição química da substância.
- A pressão altera a temperatura em que as mudanças podem ocorrer. Por exemplo, em zonas de menor pressão atmosférica, a temperatura de ebulição é menor.
- No que se refere à composição química, as substâncias puras apresentam temperatura constante durante a mudança de estado, enquanto as misturas não.
Videoaula sobre mudanças de estado físico da matéria
Quais são os tipos de mudança de estado físico da matéria?
Os processos físicos de passagem de um estado de agregação para outro são diversos. São eles:
- Fusão: passagem do estado sólido para o estado líquido.
- Vaporização: passagem do estado líquido para o estado gasoso. Pode ocorrer de três formas: evaporação, ebulição ou calefação.
- Condensação: passagem do estado gasoso para o estado líquido. Também chamado de liquefação.
- Solidificação: passagem do estado líquido para o estado sólido.
- Sublimação: passagem direta do estado sólido para o estado gasoso, sem passar pelo estado líquido.
- Ressublimação/Deposição: passagem direta do estado gasoso para o estado sólido, sem passar pelo estado líquido.
Fatores que influenciam as mudanças de estado físico da matéria
As mudanças de estado físico da matéria estão intimamente ligadas às forças de interação, que podem ter natureza metálica, iônica ou molecular. Os valores de temperatura de mudança de estado físico, principalmente fusão e ebulição, são comumente tabelados e utilizados para identificar substâncias diversas. Contudo, alguns fatores também afetam esse valor final, como a pressão e a composição química da substância. Entenda melhor obre os fatores que influenciam as mudanças de estado físico da matéria a seguir.
→ Interações metálicas, iônicas e intermoleculares
Quando uma substância está mudando de estado físico, ela está mudando o seu estado de agregação. Os sólidos possuem interações mais intensas e são mais compactos, ao passo que os gases possuem pouquíssimas interações e baixíssimo estado de agregação. Os líquidos, no meio dos dois estados, possuem comportamento intermediário no que diz respeito às interações e à compactação das partículas.

É por isso que os gases são completamente expansíveis e podem ser comprimidos, enquanto os sólidos possuem forma e volume bem definidos.
Para que ocorra a fusão, ou seja, a passagem do sólido para o líquido, a matéria deve romper interações e, para tal, necessita de energia, ou seja, a matéria deve absorver energia nesse processo. Tal energia é absorvida na forma de calor, mais especificamente o calor latente.
Quanto mais intensas forem as interações entre os constituintes do sólido, mais energia será necessária para o rompimento delas e, consequentemente, maior será a temperatura de fusão. O mesmo ocorre quando avaliamos a vaporização (ebulição): se as interações entre as partículas do líquido forem muito intensas, a temperatura de ebulição será elevada, pois haverá necessidade de maior energia para o rompimento delas.
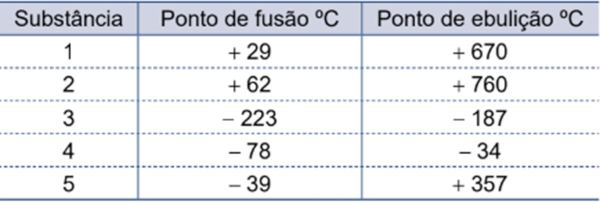
A seguir, as temperaturas de fusão e ebulição de algumas substâncias, bem como a sua natureza.
|
Substância |
T. Fusão (°C) |
T. Ebulição (°C) |
Natureza |
|
Água |
0 |
100 |
Covalente |
|
Cloreto de sódio |
800 |
1465 |
Iônica |
|
Cobre |
1083 |
2595 |
Metálica |
|
Etanol |
-119 |
78 |
Covalente |
|
Metano |
-161,6 |
-182 |
Covalente |
|
Ferro |
1538 |
2862 |
Metálica |
Importante: Em geral, as interações entre átomos metálicos são mais intensas que as realizadas por íons, seguido pelas interações realizadas entre moléculas.
→ Pressão
A pressão é um importante fator quando falamos de mudanças de estado físico. Em geral, as tabelas apresentadas estão padronizadas com pressão em nível do mar (1 atm de pressão).
Mesmo abaixo da sua temperatura de ebulição, uma parte das partículas do líquido passa para o estado gasoso. Essas partículas gasosas exercem pressão sobre a superfície do líquido, um fenômeno conhecido como pressão de vapor. Quando a pressão de vapor se iguala à pressão atmosférica, o líquido entra em ebulição. Em altitudes maiores, a pressão atmosférica é menor e, por isso, os líquidos entram em ebulição em uma menor temperatura.
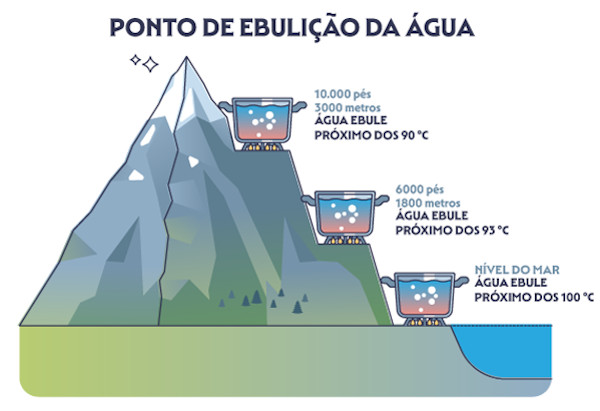
No ponto mais alto do planeta, o monte Everest (8848 metros de altitude), a água entra em ebulição próximo dos 68 °C.
Sendo menos compressíveis que os gases, a influência da pressão em líquidos e sólidos, no que diz respeito à fusão/solidificação, é menor, mas ela existe. Em geral, os sólidos são mais densos que o líquido (ocupam um menor volume), já que são mais compactos. Quando se aumenta a pressão, as partículas se aproximam, o que facilita a solidificação, mas dificulta a fusão, exigindo desta mais energia para ocorrer.
Assim sendo, o aumento da pressão aumenta a temperatura de fusão. Uma excessão é a água, cujo estado sólido (gelo) é menos denso que o líquido. Dessa forma, a avaliação é ao contrário: um aumento da pressão favorece a fusão, já que a forma líquida é a mais compacta.
→ Composição química
Substâncias puras (aqueles sistemas em que só há uma única substância) mantêm sua temperatura de mudança de estado físico constante, ou seja, durante uma fusão ou uma condensação, por exemplo, a temperatura não se altera se a substância for pura.
Contudo, quando estamos diante de uma mistura, formada por substâncias puras de diferentes temperaturas de mudança de estado físico, o comportamento já não é o mesmo, de modo que as misturas variam sua temperatura durante uma mudança de estado físico. Isso porque a taxa de mudança de estado não é igual para todos os componentes da mistura.
Por exemplo, imaginemos a mistura água e álcool etílico (etanol). O ponto de solidificação da água é igual a 0 °C, enquanto do álcool etílico é de -119 °C. Quanto mais água no sistema, mais próximo de 0 °C será o ponto de solidificação, já quanto mais etanol, mais próximo o ponto será de -119 °C.
Conforme se congela uma mistura de ambos, percebe-se que a mistura vai se concentrando em etanol, pois a água, por ter maior ponto de solidificação, congela-se antes. A cada instante que se passa, a composição se altera (com menos água e mais etanol), mudando a temperatura de solidificação, e assim até que haja congelamento total da amostra. Por isso, não há como a temperatura se manter constante durante a mudança de estado físico de uma mistura.
Fato análogo ocorre na ebulição. Uma mistura de água e sal não ferve em temperatura constante: a água, com menor ponto de ebulição (100 °C), vaporiza-se primeiro, enriquecendo a mistura em sal. Com isso, a cada instante, a temperatura de ebulição da substância aumenta, já que a composição está se alterando (mistura cada vez mais rica em sal).
Gráficos de mudanças de estado físico
Para uma substância pura, as mudanças de estado físico ocorrem em temperatura ambiente. Se o sistema estiver aquecendo, com base em uma amostra sólida, o perfil a ser observado, para qualquer substância pura, é o seguinte:
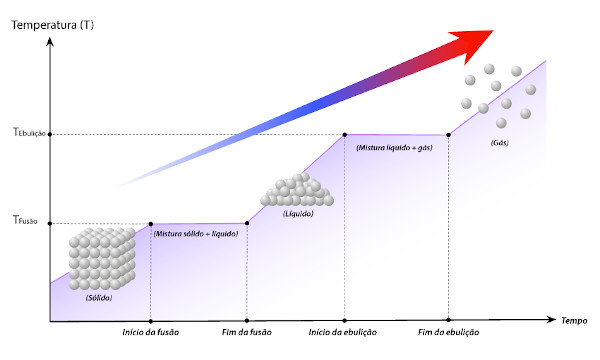
Com esse gráfico é possível determinar as temperaturas de fusão e ebulição, além da duração das mudanças de estado físico. Perceba ainda que, durante as mudanças de estado, há coexistiência das fases: sólido e líquido, na fusão; líquido e gás, na ebulição.
De modo análogo, caso a substância esteja se resfriando, o perfil observado, com base numa amostra gasosa de uma substância pura, será:
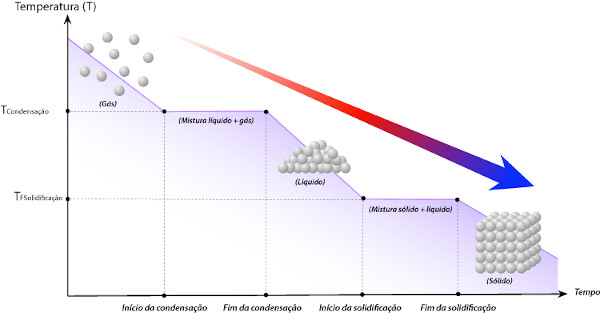
Um ponto importante é perceber que, para uma substância pura, o ponto de ebulição é igual ao ponto de condensação, enquanto o ponto de fusão é igual ao ponto de solidificação.
Diagrama de fases
O diagrama de fases é um gráfico que apresenta os estados de determinada substância em diferentes condições de temperatura e pressão. A seguir, um diagrama de fases hipotético.
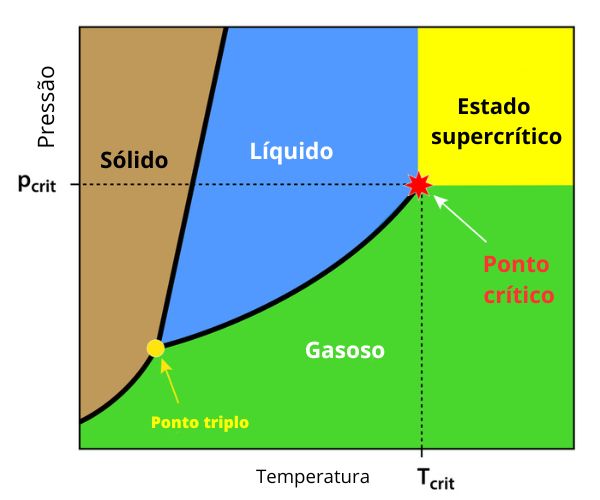
O gráfico é bidimensional, tendo como eixo x a temperatura e o eixo y a pressão. Em uma pressão e uma temperatura hipotéticas, é possível perceber em qual região do diagrama de fases estará a substância (sólido, líquido ou gasoso). As linhas de fronteira marcam as mudanças de estado físico em diferentes pressões. Perceba que a sublimação (passagem do sólido para gás) ocorre em condições de baixa pressão se comparada à fusão e à ebulição. É por isso que, nem sempre, ela é perceptível em condições ambiente.
O ponto triplo (encontro das linhas de fronteira) é um ponto específico de pressão e temperatura em que há coexistência dos três estados da matéria. A partir dele, as fases líquida e gasosa se tornam idênticas, sem distinção entre si. A temperatura crítica (Tcrit) marca a temperatura a partir da qual um gás não pode mais ser liquefeito por meio da compressão.
Por isso que gases como hélio, xenônio, metano, nitrogênio, oxigênio, monóxido de carbono, entre outros, não se liquefazem com o aumento da pressão em temperatura ambiente, pois sua temperatura crítica é menor que a temperatura ambiente. Isso já é diferente para gases como butano, propano e dióxido de carbono, os quais podem ser liquefeitos em temperatura ambiente por compressão, pois a temperatura crítica deles é superior à temperatura ambiente.
Veja também: Fenômenos físicos e químicos da matéria — qual a diferença?
Exercícios resolvidos sobre as mudanças de estado físico da matéria
Questão 1
(Uerj) Observe no diagrama as etapas de variação da temperatura e de mudanças de estado físico de uma esfera sólida, em função do calor por ela recebido. Admita que a esfera é constituída por um metal puro.
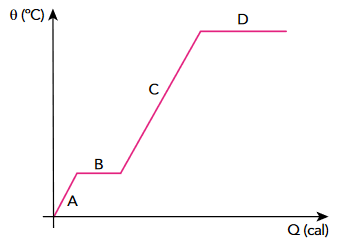
Durante a etapa D, ocorre a seguinte mudança de estado físico:
A) fusão
B) sublimação
C) condensação
D) vaporização
Resolução:
Alternativa D
A questão deixa claro no enunciado que a esfera sólida, constituída por um metal puro, está recebendo calor. Isso é perceptível no gráfico, já que o calor está positivo (eixo horizontal). Consequentemente, percebemos que a temperatura está, de modo geral, ascendente, indicando que a amostra está se aquecendo ao longo de todo o processo.
Por isso, os processos B e D, em que a temperatura está constante, marcam mudanças de estado físico. Como D ocorre em uma temperatura maior que B, é possível concluir que se trata da vaporização.
Questão 2
(Enem) Para assegurar a boa qualidade de seu produto, uma indústria de vidro analisou um lote de óxido de silício (SiO2), principal componente do vidro. Para isso, submeteu uma amostra desse óxido ao aquecimento até sua completa fusão e ebulição, obtendo ao final um gráfico de temperatura T (°C) versus tempo t (min). Após a obtenção do gráfico, o analista concluiu que a amostra encontrava-se pura.
Dados do SiO2: Tfusão = 1600 °C; Tebulição = 2230 °C.
Qual foi o gráfico obtido pelo analista?
A)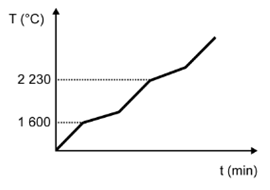
B)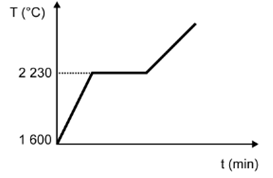
C) 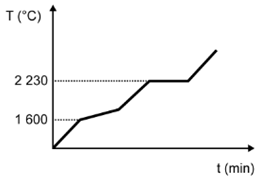
D) 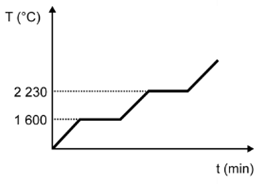
E) 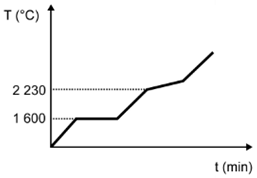
Resolução:
Alternativa D
Sendo a amostra pura, as temperaturas de fusão e ebulição ocorrem em temperatura constante. O gráfico que demonstra esse perfil é o que está na alternativa D.
Por Stéfano Araújo Novais
Professor de Química