O modelo atômico de Dalton é o modelo atômico que foi proposto por John Dalton em 1808, tendo ficado conhecido também como “modelo da bola de bilhar”. Sua teoria foi desenvolvida a partir da observação de que elementos diferentes reagem em proporções diferentes para formar compostos diferentes. Nesse sentido, essa teoria afirma que todos os elementos são compostos de átomos, que são indivisíveis e indestrutíveis. Além disso, os átomos de um elemento são idênticos em tamanho, massa e outras propriedades.
Leia também: Modelo atômico de Thomson — o modelo atômico conhecido também como “modelo pudim de passas”
Tópicos deste artigo
- 1 - Resumo sobre o modelo atômico de Dalton
- 2 - Videoaula sobre o modelo atômico de Dalton
- 3 - O que diz a teoria atômica de Dalton
- 4 - Características do modelo atômico de Dalton
- 5 - Representação do modelo atômico de Dalton
- 6 - Mapa mental sobre o modelo atômico de Dalton
- 7 - Postulados de Dalton
- → Toda matéria é composta por partículas extremamente pequenas chamadas de átomos
- → Os átomos de um elemento são idênticos em massa e em propriedades
- → Os átomos não podem ser criados nem destruídos em reações químicas
- → As reações químicas envolvem a combinação de átomos em proporções inteiras e simples
- → Os átomos se combinam em proporções simples e inteiras para formar compostos
- 8 - Quem foi John Dalton?
- 9 - Exercícios resolvidos sobre o modelo atômico de Dalton
Resumo sobre o modelo atômico de Dalton
-
O modelo atômico de Dalton é o modelo atômico que foi proposto por John Dalton em 1808.
-
É conhecido também como “modelo da bola de bilhar”.
-
Dalton propôs que os átomos são partículas indivisíveis e fundamentais da matéria.
-
Todos os átomos de um mesmo elemento são considerados idênticos em massa e propriedades.
-
Os átomos combinam-se em proporções fixas e simples para formar compostos.
-
Os átomos não são criados nem destruídos durante reações químicas, apenas se rearranjam.
-
Dalton formulou a Lei das Proporções Definidas e a Lei das Proporções Múltiplas, fundamentais para a teoria atômica.
-
John Dalton (1766-1844) foi um químico, meteorologista e físico britânico que fez importantes contribuições para a ciência.
Videoaula sobre o modelo atômico de Dalton
O que diz a teoria atômica de Dalton
Também conhecido como “modelo da bolha de bilhar”, o modelo atômico de Dalton foi proposto por John Dalton em 1808 e foi o primeiro modelo atômico com base científica. Segundo esse modelo, a matéria é composta por pequenas partículas indivisíveis, chamadas de átomos.
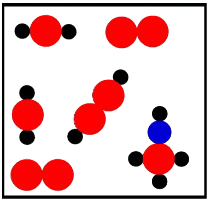
Dalton também propôs que compostos químicos são formados quando átomos de diferentes elementos se combinam em proporções fixas e simples. Por exemplo, ele afirmou que a água é composta por um átomo de oxigênio e dois átomos de hidrogênio.
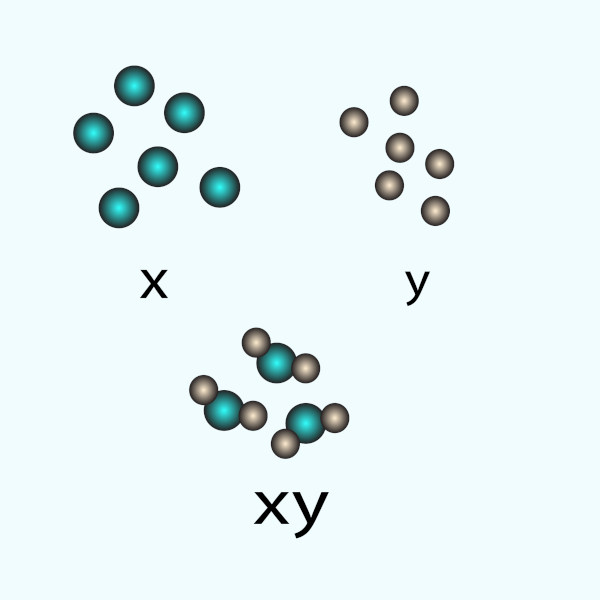
Na imagem acima, considere as bolas verdes como sendo átomos de oxigênio, enquanto as bolas cinza representam os átomos de hidrogênio.
Características do modelo atômico de Dalton
No modelo atômico de Dalton, os átomos são tidos como esferas rígidas e indivisíveis, ou seja, Dalton não reconhecia a existência de partículas subatômicas, como os prótons, os nêutrons e os elétrons. Assim sendo, podemos destacar como principais características desse modelo:
-
átomos são indivisíveis;
-
átomos do mesmo elemento são idênticos;
-
átomos se combinam em proporções fixas e simples (essa ideia é encapsulada na Lei das Proporções Definidas, também proposta por ele);
-
os átomos conservam-se em reações químicas (essa perspectiva está alinhada com o princípio da conservação da massa, de Lavoisier).
Apesar de ser simplista e incompleto, esse modelo foi um dos primeiros passos na compreensão da estrutura da matéria e ainda é ensinado nas escolas como um importante marco na história da Química.
Representação do modelo atômico de Dalton
John Dalton, ao propor seu modelo atômico, representava os átomos de forma bastante simplificada. Portanto, visualmente, os átomos seriam representados como esferas uniformes e indivisíveis, cada tipo de átomo apresentaria suas características específicas, e as reações químicas envolveriam a combinação ou rearranjo dessas esferas.

Embora essa representação seja conceitualmente básica, ela foi um passo importante na evolução da compreensão científica dos átomos e das substâncias químicas.
Mapa mental sobre o modelo atômico de Dalton
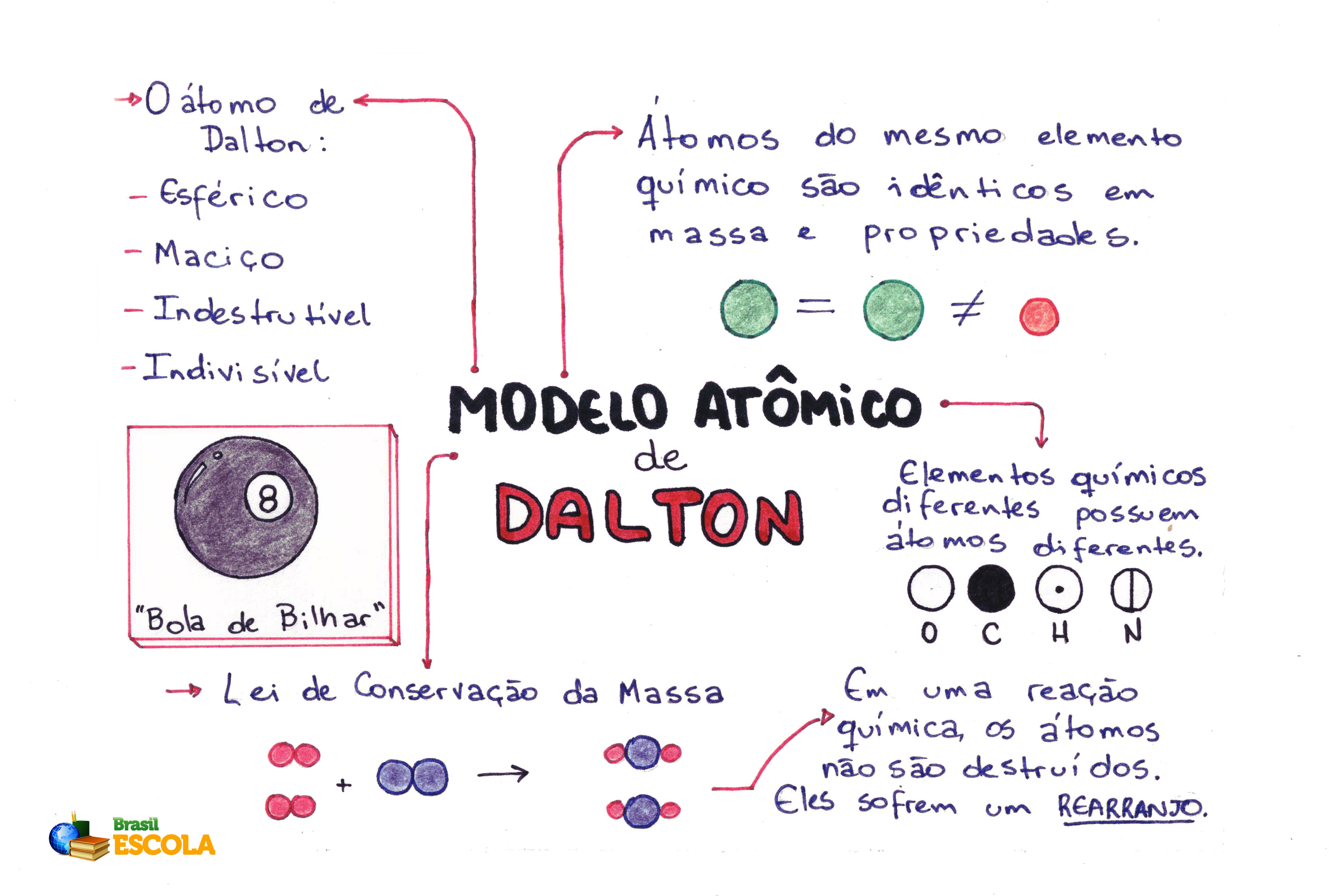
Postulados de Dalton
John Dalton formulou uma série de postulados que constituíram a base do seu modelo atômico. Esses postulados são os seguintes:
→ Toda matéria é composta por partículas extremamente pequenas chamadas de átomos
Dalton propôs que a matéria é formada por partículas indivisíveis, chamadas de átomos, que são as unidades fundamentais e não podem ser divididas em partes menores.
→ Os átomos de um elemento são idênticos em massa e em propriedades
Todos os átomos de um mesmo elemento são iguais em massa, tamanho e outras propriedades químicas, assim como átomos de elementos diferentes têm diferentes propriedades.
→ Os átomos não podem ser criados nem destruídos em reações químicas
Dalton afirmou que os átomos não são criados nem destruídos durante uma reação química. As reações químicas envolvem apenas o rearranjo dos átomos para formar novas substâncias.
→ As reações químicas envolvem a combinação de átomos em proporções inteiras e simples
Dalton propôs a Lei das Proporções Definidas, que afirma que os elementos se combinam em proporções fixas e definidas para formar compostos. Essas proporções são expressas em números inteiros simples.
→ Os átomos se combinam em proporções simples e inteiras para formar compostos
Quando dois ou mais elementos se combinam para formar um composto, eles fazem isso em proporções simples e inteiras. Isso está de acordo com a Lei das Proporções Múltiplas de Dalton.
Embora a teoria de Dalton tenha sido posteriormente modificada e refinada, ela foi um marco importante na história da Química e pavimentou o caminho para uma melhor compreensão da natureza dos átomos e moléculas.
Acesse também: Quais são todos os modelos atômicos que já foram propostos?
Quem foi John Dalton?

John Dalton (1766-1844) foi um químico, meteorologista e físico britânico conhecido por suas contribuições fundamentais para o desenvolvimento da teoria atômica e por suas pesquisas na área da meteorologia. Aqui estão alguns pontos sobre sua vida e suas contribuições:
-
John Dalton nasceu em Eaglesfield, Cumberland, Reino Unido, em 6 de setembro de 1766, em uma família modesta.
-
Sofreu com dificuldades financeiras, mas seu talento para a educação foi reconhecido, e ele se tornou professor e pesquisador autodidata.
-
É mais conhecido por sua formulação da teoria atômica.
-
Em 1803, publicou sua primeira tabela de pesos atômicos.
-
Em 1808, apresentou a ideia de que os elementos são compostos por átomos indivisíveis.
-
Teve interesse em meteorologia e fez contribuições significativas para o estudo do comportamento dos gases na atmosfera.
-
Desenvolveu a Lei das Pressões Parciais, que descreve como a pressão total de uma mistura gasosa é a soma das pressões parciais dos gases individuais.
-
Foi o primeiro a reconhecer a condição de daltonismo (disfunção visual que afeta a percepção das cores) que ele mesmo experimentou, embora o termo tenha sido cunhado após sua morte em sua homenagem.
-
Recebeu a Medalha Real da Royal Society, em 1826, por suas contribuições científicas.
Por fim, John Dalton faleceu em Manchester, Reino Unido, em 27 de julho de 1844. Suas contribuições para a química e meteorologia tiveram um impacto duradouro, e ele é lembrado como um dos pioneiros fundamentais na compreensão da natureza dos átomos e das reações químicas.
Exercícios resolvidos sobre o modelo atômico de Dalton
Questão 1
(Unifor) Os átomos:
I. diferem de elemento para elemento;
II. são as unidades envolvidas nas transformações químicas;
III. são indivisíveis;
IV. consistem de unidades com um núcleo e uma eletrosfera onde se localizam os elétrons.
Dessas afirmações, estão incluídas na teoria atômica de Dalton (1808), somente:
A) I
B) I e II
C) III e IV
D) II, III e IV
E) I, II e III
Resolução:
Alternativa E.
As opções I, II, e III estão de acordo com os postulados de Dalton, enquanto a opção IV está errada, pois se refere ao modelo atômico de Bohr.
Questão 2
(PUC) Assinale a afirmativa que descreve ADEQUADAMENTE a teoria atômica de Dalton. Toda matéria é constituída de átomos:
A) os quais são formados por partículas positivas e negativas.
B) os quais são formados por um núcleo positivo e por elétrons que gravitam livremente em torno desse núcleo.
C) os quais são formados por um núcleo positivo e por elétrons que gravitam em diferentes camadas eletrônicas.
D) e todos os átomos de um mesmo elemento são idênticos.
Resolução:
Alternativa D.
Conforme os postulados de Dalton, todos os átomos de um mesmo elemento são idênticos.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Fundamentos: Os elementos e os átomos. In: Princípios de Química: Questionando A Vida Moderna e o Meio Ambiente. 7. ed. [s.l.] Bookman, 2018. p. 15–17.
BROWN, T. L. et al. Átomos, moléculas e íons. In: Química: A Ciência Central. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 42–44.
CONSTABLE, E. C. John Dalton – the man and the myth. Dalton Transactions, v. 51, n. 3, p. 768–776, 2022.
EMERY, A. E. John Dalton (1766-1844). Journal of Medical Genetics, v. 25, n. 6, p. 422–426, 1 jun. 1988.
FILGUEIRAS, C. A. L. Duzentos Anos da Teoria Atômica de Dalton. Química Nova na Escola, v. 20, p. 38–44, 2004.
FISHMAN, G. A. John Dalton: Though in Error, He Still Influenced Our Understanding of Congenital Color Deficiency. Ophthalmic Genetics, v. 29, n. 4, p. 162–165, 8 jan. 2008.
VIANA, H. E. B.; PORTO, P. A. O processo de elaboração da teoria atômica de John Dalton. Química Nova na Escola, v. Cadernos T, n. 7, p. 4–12, 2007.