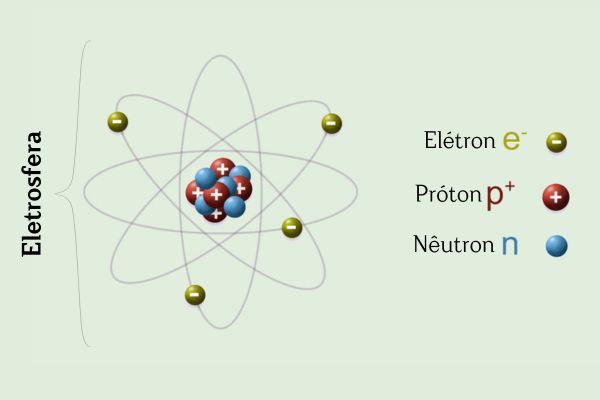
A eletrosfera é a região do átomo em que os elétrons estão localizados. A eletrosfera, de forma mais precisa, é composta por orbitais atômicos, determinados pela resolução da equação de Schrödinger. Primeiramente determinada pelo modelo de Rutherford, a eletrosfera recebeu avanços significativos durante a vigência do modelo atômico de Bohr.
A eletrosfera pode ser dividida em camadas (ou níveis de energia), pois os elétrons possuem energia definida (não contínua). Para átomos com dois ou mais elétrons, as camadas se dividem em subníveis (ou subcamadas). A eletrosfera é de suma importância para compreender propriedades do átomo e entender a formação das ligações químicas.
Leia também: Como o átomo é dividido?
Tópicos deste artigo
- 1 - Resumo sobre a eletrosfera
- 2 - Videoaula sobre eletrosfera
- 3 - O que é a eletrosfera?
- 4 - Camadas da eletrosfera
- 5 - Função da eletrosfera
- 6 - Relação entre a eletrosfera e a estrutura atômica
- 7 - Exercícios resolvidos sobre a eletrosfera
Resumo sobre a eletrosfera
-
A eletrosfera é a região do átomo em que os elétrons estão localizados.
-
É composta por orbitais atômicos, funções de onda que são soluções para as equações de Schrödinger.
-
Seu conceito se iniciou pelo modelo de Ernest Rutherford.
-
Os elétrons são mantidos na eletrosfera por conta de sua atração ao núcleo atômico.
Não pare agora... Tem mais depois da publicidade ;) -
Os principais avanços na compreensão da eletrosfera ocorreram durante a concepção do modelo de Niels Bohr.
-
É composta por camadas (ou níveis de energia), as quais são regiões de energia definida.
-
Para átomos com mais de um elétron, as camadas se dividem em subníveis (ou subcamadas).
-
A eletrosfera é importante para entendermos diversas propriedades, como semelhança atômica, estabilidade, raio atômico, energia de ionização, afinidade eletrônica, além da compreensão da formação das ligações químicas.
Videoaula sobre eletrosfera
O que é a eletrosfera?
A eletrosfera é definida como a região da estrutura atômica em que os elétrons estão localizados. Em interpretações mais aprofundadas, dizemos que ela é composta pelos orbitais atômicos, funções de onda que são soluções para a equação de Schrödinger. A expressão matemática de um orbital atômico, quando elevada ao quadrado, apresenta a densidade de probabilidade de localização do elétron em determinado ponto.
O conceito de eletrosfera começou a surgir com o modelo atômico de Ernest Rutherford, que apresenta os elétrons orbitando em torno de um núcleo denso e positivo. Posteriormente, Niels Bohr trouxe interpretações mais significativas sobre a eletrosfera ao mesclar conceitos de mecânica quântica.
Camadas da eletrosfera
Os elétrons são mantidos na eletrosfera por conta de sua atração pelo núcleo atômico. Contudo, é sabido que esses elétrons estão em camadas cujas energias são bem definidas. Tais camadas também podem ser chamadas de níveis de energia.
Essa conclusão se deu após experimentos de espectroscopia. Por exemplo, quando se aplica uma corrente elétrica no gás H2 em baixa pressão, há emissão de luz por parte do H2. Forma-se, nessa condição, íons H+ e elétrons, os quais retornarão aos íons H+ e formarão espécies excitadas (energizadas) de H+. Para aliviar o excesso de energia, os íons H+ liberam a energia na forma de radiação eletromagnética (luz) e se recombinam em gás H2 novamente.
Você deve se lembrar de que, quando uma luz branca passa por um prisma, ela se decompõe em um espectro contínuo (semelhante ao arco-íris); porém o mesmo não ocorre com a luz advinda do H2: ao passar tal radiação pelo prisma, observa-se apenas linhas brilhantes com comprimento de onda definido no espectro de emissão do H2, conhecidas como linhas espectrais.
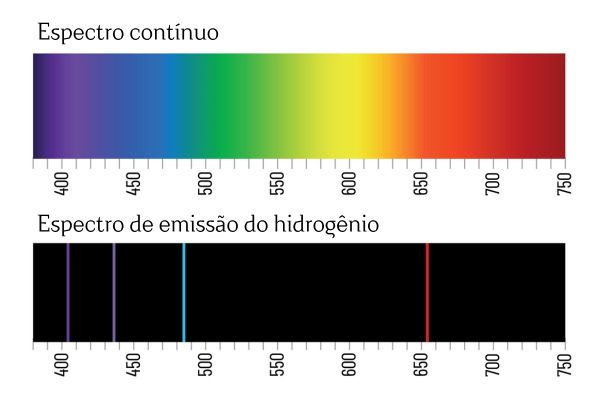
A interpretação para os espectros de emissão dos elementos (com as linhas espectrais bem definidas) é de que um elétron, em um átomo, não pode apresentar qualquer energia, mas sim em quantidades bem definidas (os chamados pacotes de energia). Caso os elétrons não tivessem tais restrições energéticas, o espectro de emissão dos elementos seria contínuo, tal qual o de uma luz branca passando por um prisma.
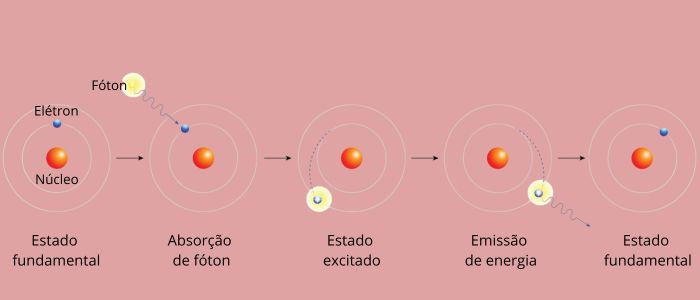
Cada linha espectral de um elemento ficou conhecida como nível de energia (ou camada, como estamos mais acostumados a falar). Essas linhas surgem quando um elétron passa de um nível de energia permitido para outro, em um processo de mudança energética conhecido como transição eletrônica.
Durante a transição eletrônica, o elétron passa de um nível permitido de menor energia para um nível permitido de maior energia. Ao retornar ao seu nível inicial, emite o excedente de energia por meio de radiação eletromagnética (luz), dando origem à linha espectral cujo valor de energia emitido é proporcional a um valor definido pela equação de Rydberg.
Johannes Rydberg foi um espectroscopista sueco que elaborou uma equação para definir a tendência das linhas espectrais com base nos trabalhos do professor suíço Johann Balmer. A energia específica de cada camada é definida pela resolução da equação de Schrödinger apropriada.
Cada camada eletrônica possui um número de elétrons permitidos. Atualmente, são definidas sete camadas eletrônicas, identificadas pelas letras K até Q, em ordem alfabética, ou pela letra n, sendo n ≥ 1. Assim, a camada K é a camada em que n = 1, e assim sucessivamente. O número de elétrons permitidos por camada é demonstrado na tabela a seguir.
|
Nível energético |
Camada |
Nº máximo de elétrons |
|
1 |
K |
2 |
|
2 |
L |
8 |
|
3 |
M |
18 |
|
4 |
N |
32 |
|
5 |
O |
32 |
|
6 |
P |
18 |
|
7 |
Q |
8 |
Para átomos hidrogenóides (com apenas 1 elétron, como H, He+, Li2+), todos os orbitais atômicos possuem a mesma energia (chamamos de orbitais degenerados); porém, em átomos com dois ou mais elétrons, surge um efeito muito importante, a repulsão elétron-elétron. A consequência desse fato é que os orbitais de cada camada começam a tomar energias diferentes e, assim sendo, as camadas começam a ser descritas como subcamadas (ou subníveis).
Para os átomos atuais, cada camada pode ser decomposta em até quatro subníveis, representados pelas letras “s” (do inglês, sharp), “p” (do inglês, principal), “d” (do inglês, diffusal) e “f” (do inglês, fundamental).
Cada subnível suporta um número máximo de elétrons, definido por cálculos e experimentos. O subnível “s” suporta até 2 elétrons; o subnível “p”, até 6 elétrons; o subnível “d”, até 10 elétrons; e o subnível “f”, até 14 elétrons. A camada K é a única que só permite um único orbital e, assim sendo, só possui um único subnível.
|
Nível energético |
Camada |
Subníveis |
|
1 |
K |
1s |
|
2 |
L |
2s, 2p |
|
3 |
M |
3s, 3p, 3d |
|
4 |
N |
4s, 4p, 4d, 4f |
|
5 |
O |
5s, 5p, 5d, 5f |
|
6 |
P |
6s, 6p, 6d |
|
7 |
Q |
7s, 7p |
Função da eletrosfera
A eletrosfera de cada átomo pode ser utilizada para explicar diversas propriedades e comportamentos do átomo.
Propriedades como raio atômico, raio iônico, energia de ionização e afinidade eletrônica possuem valores que são consequência direta da configuração eletrônica da eletrosfera, mais especificamente da chamada camada de valência, que é, na verdade, a camada eletrônica ocupada mais externa de um átomo ou íon.
A semelhança entre átomos do mesmo grupo da Tabela Periódica é também consequência da configuração eletrônica da camada de valência. Em processos químicos, escolhemos átomos do mesmo grupo da Tabela Periódica como possíveis substituintes, e isso só é plausível, pois esses átomos possuem mesma configuração eletrônica na camada de valência.
As ligações químicas, que ocorrem entre átomos para a formação dos compostos iônicos e covalantes (moléculas), também ocorrem por meio de interações entre as eletrosferas dos átomos.
Leia também: Modelo atômico de Schrödinger — forma de descrever o átomo mediante a mecânica quântica
Relação entre a eletrosfera e a estrutura atômica
Como pontuado, a eletrosfera engloba a região do átomo em que os elétrons podem ser encontrados. Os elétrons, de forma mais específica, estão localizados em orbitais atômicos, os quais possuem energia definida por cálculos quânticos.
A eletrosfera é a maior região da estrutura atômica, já que o núcleo de um átomo é muito pequeno. Pensando no átomo como um estádio de futebol, o núcleo corresponderia a uma bola no centro do campo, enquanto todo o resto do estádio seria a eletrosfera.
Entretanto, em termos de massa, a eletrosfera pouco contribui. Como a massa dos elétrons é cerca de 1836 vezes menor que a dos prótons e nêutrons, podemos dizer que quase toda a massa do átomo se concentra no núcleo.
Exercícios resolvidos sobre a eletrosfera
Questão 1
(Facisb 2023) No modelo de Bohr para o átomo de hidrogênio, o elétron só pode ocupar determinadas órbitas. Na figura estão representadas algumas dessas órbitas, em que n refere-se aos níveis de energia que o elétron possui em cada órbita.
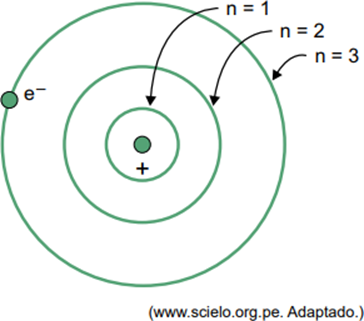
Considere que, em um átomo de hidrogênio, o elétron esteja na órbita em que n = 5.
De acordo com o modelo de Bohr, esse elétron emitirá energia na forma de radiação eletromagnética apenas quando
(A) efetuar uma transição para a órbita em que n é igual a 6.
(B) permanecer na órbita em que n = 5.
(C) efetuar uma transição para qualquer órbita em que n seja maior do que 5.
(D) efetuar uma transição para qualquer órbita em que n seja menor do que 5.
(E) for ejetado do átomo, ionizando-o.
Resposta: Letra D
Quando um elétron está em uma camada mais externa, ao retornar para uma camada mais interna e de menor energia, ele libera o excedente de energia na forma de radiação eletromagnética (luz). Assim sendo, a ocorrência de luz só ocorrerá quando o elétron presente em n = 5 efetuar uma transição para uma camada mais interna.
Questão 2
(Uerj 2019) Recentemente, cientistas conseguiram produzir hidrogênio metálico, comprimindo hidrogênio molecular sob elevada pressão. As propriedades metálicas desse elemento são as mesmas dos demais elementos do grupo 1 da tabela de classificação periódica.
Essa semelhança está relacionada com o subnível mais energético desses elementos, que corresponde a:
(A) ns1
(B) np2
(C) nd3
(D) nf4
Resposta: Letra A
O átomo de hidrogênio possui apenas um único elétron, o qual está localizado no primeiro nível, subnível “s” (1s1). Uma razão para ele se encontrar no grupo 1 da Tabela Periódica é pelo fato de todos os outros elementos químicos desse grupo possuírem átomos cuja camada de valência seja do mesmo tipo (ns1). Assim sendo, por conta de uma camada de valência semelhante é que o hidrogênio conseguiu ser produzido nessa forma metálica.
Fontes:
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
ATKINS, P.; DE PAULA, J.; KEELER, J. Atkins’s Physical Chemistry. 11 ed. Oxford: Oxford University Press, 2018.