O modelo atômico de Schrödinger é uma forma comum usada para designar a descrição do átomo por meio da resolução da equação de Schrödinger, proposta pelo físico austríaco Erwin Schrödinger no ano de 1927. A equação é concebida com base em importantes observações obtidas dentro da mecânica quântica, trazendo uma justificativa robusta para a energia do átomo e do elétron.
O átomo concebido por Schrödinger se baseia na dualidade onda-partícula, no princípio da incerteza, entre outras noções cunhadas no começo do século XX. Trouxe grandes avanços para a compreensão da matéria, pois abriu caminho para uma compreensão mais sólida de átomos polieletrônicos, algo que não é possível com o modelo atômico proposto por Bohr.
Leia também: Modelos atômicos — os modelos propostos para explicar a estrutura do átomo
Tópicos deste artigo
- 1 - Resumo sobre o modelo atômico de Schrödinger
- 2 - O que é o modelo atômico de Schrödinger?
- 3 - Base experimental para o modelo atômico de Schrödinger
- 4 - Características do modelo atômico de Schrödinger
- 5 - Avanços do modelo atômico de Schrödinger em relação aos outros modelos atômicos
Resumo sobre o modelo atômico de Schrödinger
-
O modelo atômico de Schrödinger é, na verdade, a descrição do átomo e dos elétrons por meio da equação de Schrödinger.
-
A equação de Schrödinger foi desenvolvida por meio de estudos importantes no campo da mecânica quântica.
-
A dualidade onda-partícula, o princípio da incerteza, entre outras teorias, foram essenciais para a criação da equação de Schrödinger.
-
Resolvendo a equação de Schrödinger, é possível descrever a energia do átomo bem como a do elétron.
Não pare agora... Tem mais depois da publicidade ;) -
Com base na interpretação da equação de Schrödinger, pode-se perceber que os elétrons não possuem uma órbita definida em torno do átomo, mas sim uma região de probabilidade de existência em torno dele.
-
Os estudos de Schrödinger expandem a compreensão do átomo proposta por Bohr, pois permitem uma compreensão do comportamento de átomos polieletrônicos.
O que é o modelo atômico de Schrödinger?
O modelo atômico de Schrödinger é uma denominação usual para a descrição de um modelo atômico baseado na mecânica quântica. A principal característica desse modelo é a interpretação matemática da dualidade onda-partícula adotada pelos elétrons, mais especificamente, a substituição de uma trajetória bem definida do elétron pela probabilidade de existência do elétron em torno do núcleo.
Tal interpretação se iniciou por meio dos trabalhos do cientista austríaco Erwin Schrödinger, no ano de 1927, após importantes avanços na compreensão da matéria no campo da mecânica quântica, como o efeito fotoelétrico, o princípio da incerteza e a dualidade onda-partícula.
A compreensão do modelo atômico de Schrödinger não é trivial, sendo abordada em níveis mais avançados do estudo da Química.
Base experimental para o modelo atômico de Schrödinger
Antes dos estudos de Erwin Schrödinger, existiram importantes avanços na compreensão da matéria no início do século XX. Tais experimentos iniciaram o campo de conhecimento teórico conhecido como mecânica quântica, que traz interpretações sobre o comportamento de partículas próximo ou abaixo da escala atômica. Nesse universo específico, as leis da Física clássica, também conhecida como Física newtoniana, muitas vezes não se aplicam ou não são suficientes para explicar determinados comportamentos.
Apenas para se ter noção, podemos dizer que a mecânica quântica se inicia por um tópico conhecido como a catástrofe do ultravioleta. Segundo a Física clássica, um corpo negro (objeto quente), com temperatura diferente de zero, emite radiação ultravioleta intensa, além de radiação gama e raios X.
Isso quer dizer que nós, seres humanos, com nossa temperatura de 36-37 °C, brilharíamos no escuro (consequência da incandescência). Não é preciso dizer que isso é um completo absurdo, pois se assim o fosse, não existiria escuridão.
Nesse contexto, em 1900, Max Planck criou o conceito do quanta, traduzido como “pacotes de energia”, a fim de explicar a troca de energia entre matéria e radiação. Segundo sua interpretação, um corpo em temperaturas baixas (como nós) não tem energia suficiente para emitir radiação ultravioleta de alta frequência.
Assim, um corpo só pode emitir radiação ultravioleta de alta frequência quando adquirir uma energia mínima necessária. Nessa condição, a troca de energia entre matéria e vizinhaça ocorre por meio de pacotes de energia de radiação.
Os pacotes de energia trazem também uma diferença em relação à Física clássica. Quando se fala em pacotes de energia, refere-se à energia é quantizada, ou seja, ela é específica, há uma imposição de limites. Já na Física newtoniana, a quantidade de energia trocada entre dois objetos não possui qualquer restrição.
-
Efeito fotoelétrico
Para dar robustez às teorias propostas por Planck, mais evidências eram necessárias. Nesse contexto, surgiu o efeito fotoelétrico, que versa sobre a ejeção de elétrons de um metal por meio da incidência de radiação ultravioleta sobre a sua superfície.
Segundo as observações dessa teoria, nenhum elétron é ejetado até que a radiação atinja uma frequência de determinado valor, específica para cada metal. Uma vez que essa frequência é atingida, os elétrons são ejetados imediatamente, e, quanto mais intensa for a frequência da radiação incidente, maior velocidade terá o elétron ejetado.
A explicação para o efeito fotoelétrico foi dada por Albert Einstein. Segundo Einstein, a radiação eletromagnética (a luz, por exemplo, é uma radiação eletromagnética), utilizada para a ejeção dos elétrons, era composta por partículas conhecidas como fótons, e, além disso, cada fóton poderia ser interpretado como um pacote de energia. Com base nos estudos de Planck, foi possível concluir que fótons de radiação ultravioleta são mais energéticos que fótons da luz visível.
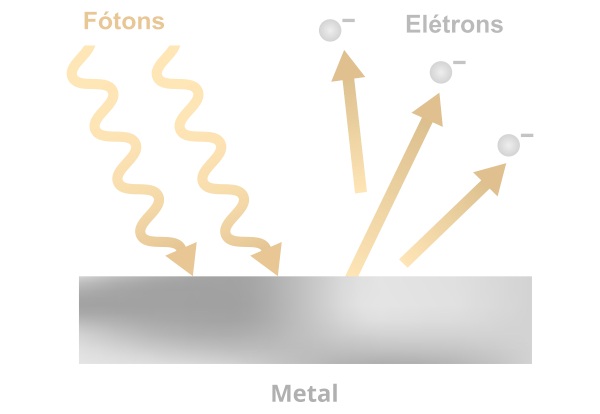
Ao colidir com a superfície do metal, os fótons (constituintes da radiação eletromagnética) trocam energia com os elétrons lá presentes. Se a energia absorvida pelo elétron a partir da colisão com os fótons for suficientemente grande, ele então será ejetado.
-
Dualidade onda-partícula
O efeito fotoelétrico trouxe um forte embasamento de que a radiação eletromagnética é composta por partículas (fótons). Contudo, muitos outros experimentos indicavam que a radiação eletromagnética possuía comportamento de uma onda. Desses experimentos, o mais contundente era a difração — o fenômeno físico observado quando uma onda encontra um obstáculo ou, por outra interpretação, a capacidade das ondas em contornar obstáculos.
O caráter ondulatório da luz já era conhecido desde 1801, quando o Físico inglês Thomas Young fez incidir luz sobre uma barreira com uma fenda. Quando passa por essa fenda, a luz sofre difração. A cada fenda, inclusive, que a luz passa, mesmo difratada, ela sofre uma nova difração.

Assim, foi necessário aceitar um novo comportamento para a radiação eletromagnética: a dualidade onda-partícula. A partir daí, o cientista francês Louis de Broglie expandiu esse conceito, sugerindo que todas as partículas também deveriam ser entendidas como tendo comportamento de ondas.
A hipótese de Broglie ganhou força em 1925, quando os cientistas norte-americanos Clinton Davisson e Lester Germer comprovaram que um feixe de elétrons era capaz de sofrer difração ao passar por um monocristal de níquel.
Essa percepção foi essencial para se chegar à conclusão de que partículas mais pesadas, como moléculas, também eram capazes de sofrer difração e, assim, apresentar comportamento ondulatório.
-
Princípio da incerteza
Na Física clássica, é fácil você determinar a trajetória de uma partícula. Contudo, no mundo quântico, no qual as partículas também apresentam comportamento de onda, a trajetória delas já não é tão precisa assim. Isso porque não faz sentido se falar na localização de uma onda.
Por exemplo, em um violão, ao tocar-se uma corda, a onda se espalha por toda a sua extensão. Se uma partícula tem esse mesmo comportamento, não há como definir a sua localização com exatidão, mesmo conhecendo o seu momento linear (grandeza que mescla a massa e a velocidade).
Sendo assim, o elétron, que também apresenta caráter dual, não possui uma órbita/trajetória definida em torno do núcleo atômico, como muitos acreditam. A dualidade cria então uma incerteza acerca da posição exata da partícula.
Essa incerteza na definição da posição é desprezível para corpos muito pesados, mas totalmente significativa para corpos de dimensão atômica ou subatômica, ou seja, se você sabe que a partícula está em determinado lugar, em determinado instante, não saberá mais em que local ela estará no próximo instante.
Desse dilema surgiu o princípio da incerteza, estabelecido pelo físico alemão Werner Heisenberg, em 1927. Segundo esse princípio, não é possível saber a posição e o momento linear de uma partícula sem uma margem de erro, ou seja, se uma propriedade é conhecida, a outra não será.
Características do modelo atômico de Schrödinger
Como, a partir do caráter dual da partícula, não se podia mais definir uma trajetória específica para ela, em 1927, o cientista austríaco Erwin Schrödinger substituiu essa trajetória precisa por uma função de onda, representada pela letra grega psi (ψ), com os valores dessa função variando de acordo com a posição. Um exemplo de função de onda é a função seno de x.
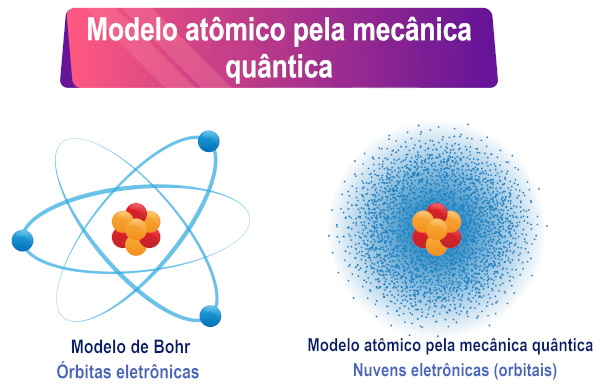
O cientista Max Born, então, criou uma interpretação física para a função de onda, afirmando que o quadrado da função ψ, ou seja, ψ², seria proporcional à probabilidade de encontrar uma partícula em uma região. Dessa forma, entende-se ψ² como a densidade de probabilidade de se encontrar uma partícula em alguma região. Por ser uma densidade de probabilidade, deve-se multiplicar o valor de ψ² pelo volume para se ter a real probabilidade.
Para se calcular a função de onda, Schrödinger desenvolveu uma equação, simplificada da seguinte forma:
Hψ = Eψ
Hψ deve ser lido como “hamiltoniano de psi”, e descreve a curvatura da função de onda. O hamiltoniano é um operador matemático, assim como o sinal de adição, subtração, log etc. Já o lado direito nos traz a energia correspondente.
A resolução dessa equação nos traz uma importante conclusão: as partículas podem apenas apresentar energias discretas, ou seja, energias bem determinadas, ou quantizadas, e não qualquer valor. Esses valores específicos de energia são conhecidos como níveis de energia. Isso é uma imposição da função de onda, pois esta precisa se ajustar em uma região do espaço específica. Na mecânica clássica, um objeto pode ter qualquer valor de energia total.
Assim, um elétron não pode ter qualquer energia, mas sim níveis de energia bem definidos. Como a função de onda precisa se ajustar a uma região do espaço, lembre-se de que um elétron está confinado dentro de um átomo por meio das forças de atração que este possui pelo núcleo.
Os níveis de energia de um átomo podem ser calculados pela resolução apropriada da equação de Schrödinger. Nesse caso, percebe-se que a resolução alcança uma nova equação, a qual demonstra que a energia de cada nível no átomo depende de um número inteiro, chamado de n, o que corrobora com a ideia de que os níveis de energia possuem valores específicos.
Assim, atribuindo-se valores positivos para n (1, 2, 3...), é possível calcular a energia dos níveis atômicos. O parâmetro n passa a ser chamado de número quântico principal, pois acaba ligado a cada nível atômico permitido para um átomo.
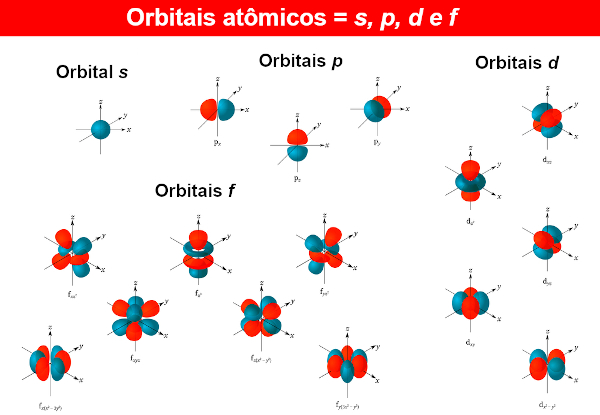
As funções de onda dos elétrons são chamadas de orbitais atômicos, cujas expressões matemáticas também são obtidas por meio da resolução da equação de Schrödinger. Um orbital atômico apresenta a distribuição do elétron em um átomo, ou seja, a região de probabilidade de existência de um elétron em um átomo. Os orbitais atômicos podem apresentar formas e energias diferentes, também obtidas pela equação de Schrödinger.
Para cada nível de energia n (lembrando que n pode ser 1, 2, 3...), existem n subníveis. Em cada subnível, estão orbitais de formas diferentes. Não há um limite para orbitais diferentes, mas, com os átomos conhecidos até então, os químicos utilizam apenas quatro deles, identificados pelas letras s, p, d e f.
Então, por exemplo, no nível n = 1, há apenas um único subnível, havendo assim apenas o orbital s. Já para o nível n = 2, há dois subníveis, estando presentes os orbitais s e p.
Avanços do modelo atômico de Schrödinger em relação aos outros modelos atômicos
Como mencionado, Schrödinger não apresentou necessariamente um modelo mas sim uma interpretação matemática para fenômenos observados acerca da natureza das partículas. Por isso, a sua interpretação se torna complexa, uma vez que a própria equação de Schrödinger necessita de conhecimentos matemáticos avançados para sua resolução e, inclusive, para sua interpretação.
Contudo, os estudos de Schrödinger trouxeram uma grande robustez para justificar a energia dos átomos e dos elétrons presentes. Por exemplo, a resolução da equação de Schrödinger confirma o modelo atômico de Bohr para o átomo de hidrogênio e demais átomos hidrogenóides (aqueles que só possuem 1 elétron). Assim como Schrödinger, Bohr chegou aos níveis de energia permitidos para o átomo de hidrogênio.
Porém o modelo atômico de Bohr não é capaz atingir os níveis eletrônicos para átomos com mais de 1 elétron e, assim, demonstra sua principal fraqueza. Quando dois elétrons estão presentes, é necessário considerar a repulsão eletrônica entre eles, um parâmetro que pode ser adicionado à compreensão matemática proposta por Schrödinger.
Outro ponto importante dos estudos de Schrödinger é a adaptação de conceitos quânticos, como a dualidade da partícula, assim como uma trajetória exata para um elétron. A definição de orbital atômico é muito importante para a compreensão da estrutura de todos os átomos. A densidade de probabilidade (ψ²) nos ajuda entender como os elétrons ocupam os orbitais atômicos em átomos polieletrônicos, trazendo informações mais específicas acerca da energia do elétron.
Por Stéfano Araújo Novais
Professor de Química

