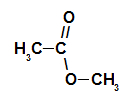Os ésteres são compostos orgânicos oxigenados que são formados pela reação química entre um ácido carboxílico e um álcool. Apresentam o grupo funcional (composto por dois átomos de oxigênio e dois radicais R) representado a seguir:
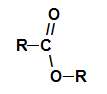
Grupo funcional geral de um éster
Estruturalmente, o que caracteriza o éster é a presença de algum radical alquila ligado diretamente ao átomo de oxigênio. Nesse caso, o radical (R) unido ao carbono – que, por sua vez, está duplamente ligado ao oxigênio – pode ser tanto um radical alquila quanto um átomo de hidrogênio.
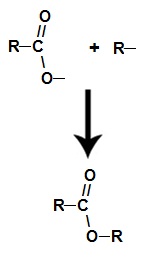
Trata-se da reação química que origina um éster e uma molécula de água a partir da interação entre um ácido carboxílico e um álcool qualquer, como na equação abaixo:
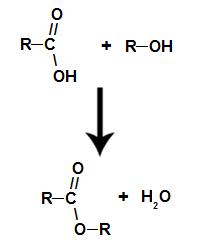
Equação química que representa a formação de um éster
Durante a esterificação, o grupo hidroxila (OH) do álcool interage com o hidrogênio (H) ionizável da hidroxila do ácido e forma a molécula de água.
![]()
Grupos formadores da molécula de água na esterificação
Já o éster é formado pela ligação do radical (R) do álcool com o oxigênio, que sobrou da hidroxila do ácido depois da formação da água.
Características dos ésteres
Principais propriedades físicas apresentadas pelos ésteres:
-
Possuem aroma de frutas e flores;
-
Ésteres de baixa massa molar são líquidos à temperatura ambiente e os de alta massa molar são sólidos;
-
Quando comparados com os alcoóis e ácidos carboxílicos, os ésteres apresentam pontos de fusão e ebulição mais baixos;
-
Em comparação com a água, os ésteres de menor massa molar são menos densos;
-
Os ésteres de menor massa molar são polares e os de maior massa molar são apolares;
-
Nos ésteres polares, predominam forças dipolo permanente; já nos apolares, predominam forças dipolo induzido;
-
Os ésteres de menor massa molar são pouco solúveis em água e os de maior massa são insolúveis em água.
Regra de nomenclatura de um éster
Antes de utilizar a regra de nomenclatura de um éster, é fundamental relembrarmos que esse composto é formado pela união de duas partes, uma proveniente do ácido carboxílico (em vermelho) e a outra do álcool (em azul), como representado pela imagem a seguir:
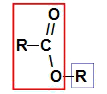
Identificação das partes que originam o éster
De acordo com a União Internacional da Química Pura e Aplicada (IUPAC), a regra oficial para nomear um éster é:
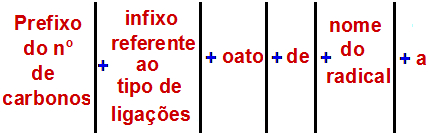
Regra de nomenclatura de um éster
Obs.: O prefixo e o infixo sempre correspondem à parte do ácido carboxílico, e o radical corresponde à do álcool.
Observe a seguir alguns exemplos de aplicação da regra de nomenclatura para ésteres:
1º Exemplo: Essência de framboesa
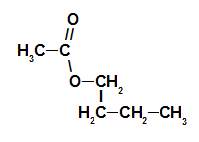
Fórmula estrutural do éster da essência de framboesa
Para nomear esse éster, utilizamos:
-
Prefixo do no de carbonos: et, pois o ácido formador tem dois carbonos;
-
Infixo sobre o tipo de ligações: an, pois o ácido formador tem apenas ligações simples entre os carbonos;
-
oato;
-
de;
-
Radical: butil, por ter quatro carbonos em sequência;
-
a.
Assim, o nome do éster correspondente à essência de framboesa é etanoato de butila.
2º Exemplo: Essência de pinha
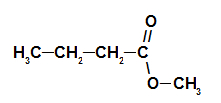
Fórmula estrutural do éster da essência de pinha
Para formar o nome desse éster, utilizamos:
-
Prefixo do no de carbonos: but, pois ácido formador tem quatro carbonos;
-
Infixo sobre o tipo de ligações: an, pois o ácido formador tem apenas ligações simples entre os carbonos;
-
oato;
-
de;
-
Radical: metil, pois o álcool formador possui apenas um carbono;
-
a.
Assim, o nome do éster correspondente à essência de pinha é butanoato de metila.
3º Exemplo: Essência de morango
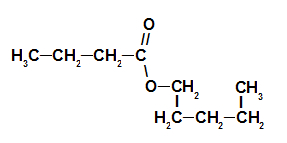
Fórmula estrutural do éster da essência de morango
Para nomear esse éster, utilizamos:
-
Prefixo do no de carbonos: but, pois o ácido formador tem quatro carbonos;
-
Infixo sobre o tipo de ligações: an, pois o ácido formador tem apenas ligações simples entre os carbonos;
-
oato;
-
de;
-
Radical: pentil, pois o álcool formador possui cinco carbonos em sequência;
-
a.
Assim, o nome do éster correspondente à essência de morango é butanoato de pentila.
Utilizações dos ésteres
Os ésteres são muito conhecidos pelo uso como flavorizantes em alimentos industrializados, ou seja, substâncias que simulam o sabor e o aroma característico de alimentos naturais, como frutas. Além disso, os ésteres são usados ainda na fabricação de medicamentos, cosméticos, perfumes e ceras.
Por Me. Diogo Lopes Dias