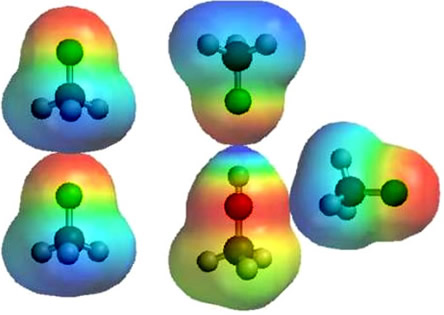
As forças intermoleculares, genericamente chamadas de Forças de Van der Waals, são três: dipolo induzido-dipolo induzido, ligações de hidrogênio e dipolo permanente-dipolo permanente. Neste texto, consideraremos apenas a última dessas três forças:
A força dipolo permanente-dipolo permanente, ou simplesmente, dipolo-dipolo ocorre somente em moléculas polares, isto é, aquelas que não apresentam distribuição uniforme de carga ao longo de sua superfície. Para citar um exemplo, na molécula de HCl (gás clorídrico) a nuvem eletrônica está mais deslocada no sentido do átomo de cloro, pois ele é mais eletronegativo que o hidrogênio.
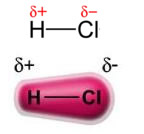
Observe que ao redor do átomo de cloro há um acúmulo de elétrons, o que acarreta a formação de um polo negativo, que é simbolizado pela letra grega delta (-δ). Em consequência, na região ao redor do átomo de hidrogênio é formado um polo positivo (+δ), pois possui baixa densidade eletrônica. A molécula de HCl constitui, então, um dipolo elétrico e, com isso, ao entrar em contato com outras moléculas de HCl vizinhas, ocorre uma força de atração entre os polos contrários das moléculas, conforme é possível visualizar logo abaixo:
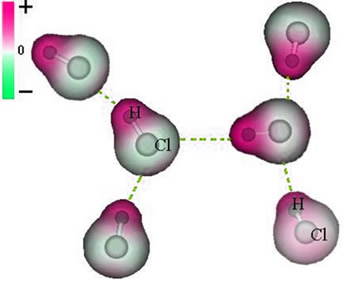
Essa força de atração que se estabelece entre a extremidade negativa do dipolo de uma molécula com a extremidade positiva do dipolo de outra molécula, constitui a força dipolo-dipolo.
Assim, como o próprio nome diz, o dipolo é permanente, por isso ela ocorre só em compostos polares. E quanto maior a polaridade de uma molécula, mais intensas serão as interações dipolo-dipolo na substância.
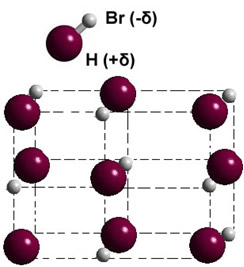
Se estiver na fase sólida, a formação do dipolo permanente orienta a posição de cada molécula no espaço, formando cristais dipolares; como ocorre no caso do brometo de hidrogênio ilustrado a seguir:
Outros exemplos de substâncias polares que possuem a força dipolo-dipolo entre as suas moléculas são: H2S, CO, HCCl3, SO2.
Essa força intermolecular é de intensidade média, pois se apresenta mais forte que a força de atração dipolo induzido-dipolo induzido, porém menos intensa que a ligação de hidrogênio. É por isso que seus pontos de fusão e ebulição são maiores que os das substâncias que possuem força de dipolo induzido. Como a força dipolo permanente é mais forte, é necessário o fornecimento de mais energia para que as interações de suas moléculas se rompam.
Por Jennifer Fogaça
Graduada em Química