Dentre as forças intermoleculares, as forças dipolo induzido-dipolo induzido são as únicas que não foram estudadas pelo físico holandês Johannes Diederik Van der Waals (1837-1923). Elas foram elucidadas pelo físico alemão Fritz Wolfgang London (1900-1954), por isso essas forças também são denominadas de forças de London ou forças de dispersão de London. Outra denominação dada a essas forças é dipolo instantâneo-dipolo induzido.
Esse tipo de força ocorre em substâncias apolares, como o H2, O2, F2, Cl2, CO2, CH4 e C2H6, entre outras. E podem ocorrer também entre átomos de gases nobres, quando estes se aproximam, causando repulsão entre suas eletrosferas. Desse modo, os elétrons se acumulam em determinado lado, que fica polarizado negativamente e o lado oposto positivamente, em razão da deficiência de carga negativa.
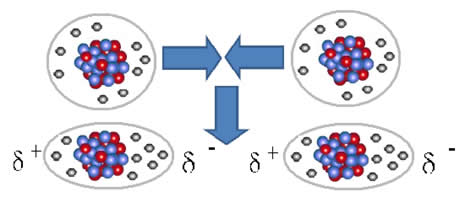
As moléculas apolares podem passar do estado gasoso – em que elas estão muito distanciadas e não há nenhuma interação, pois não há polos –, para o estado líquido e sólido. Nesses estados de agregação, as moléculas estão mais próximas e as atrações ou repulsões eletrônicas entre seus elétrons e núcleos podem levar a uma deformação de suas nuvens eletrônicas, momentaneamente, originando polos positivos e negativos temporários.
Os dipolos instantâneos podem induzir a polarização de moléculas vizinhas, resultando em forças atrativas.
Essa indução pode ocorrer também entre moléculas diferentes e geralmente essas forças são mais fracas de intensidade que as forças de dipolo-dipolo e a da ligação de hidrogênio. Por isso, sólidos com essa força de interação como o gelo-seco (dióxido de carbono - CO2) e o iodo (I2), que estão no estado sólido, sublimam (passam para o estado gasoso); porque a energia necessária para romper suas interações é pequena.
Um exemplo de forças intermoleculares entre moléculas polares e apolares ocorre entre o gás oxigênio (apolar) e a água (polar). Acontece que a extremidade negativa da água se aproxima do O2, se repelindo e, assim, a nuvem eletrônica da molécula apolar se afasta. O oxigênio fica, então, momentaneamente polarizado e passa a interagir com a água se solubilizando nela.
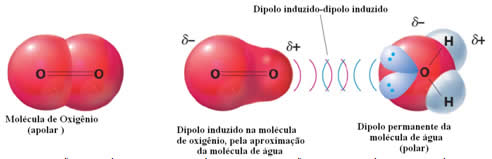
Visto que essas forças são fracas, a solubilidade desse gás em água é pequena. Mesmo assim, sua presença é essencial para preservar a vida de vários organismos aquáticos.
Essa força de interação ocorre também na natureza, dando a aderência entre as patas das lagartixas e a superfície por onde caminham. Por isso elas conseguem caminhar sobre paredes e tetos sem cair ou grudar.
Por Jennifer Fogaça
Graduada em Química
Equipe Brasil Escola



