O estudo da força de um ácido é muito importante para a determinação da capacidade da solução ácida de conduzir corrente elétrica, já que esta se relaciona com a quantidade de íons que essa substância produz quando em contato com água (ionização). Quando um ácido é muito forte, ele produz muitos cátions hidrônios (H3O+) e muitos ânions (X-). Veja a equação da ionização do ácido bromídrico:
HBr + H2O → H3O+ + Br-
Ao ionizar-se, o hidrogênio presente na molécula do ácido interage com a molécula de água e forma o hidrônio. Mas para que esse evento aconteça, o átomo de hidrogênio deve ser obrigatoriamente ionizável. O hidrogênio ionizável é aquele capaz de formar um cátion hidrônio. Para saber se um hidrogênio é ionizável, levamos em consideração a classificação do ácido em hidrácido (não possui oxigênio na sua composição) ou oxiácido (possui oxigênio na sua composição).
a) Hidrácidos
Todo hidrogênio de um hidrácido é considerado ionizável.
Exemplos:
- HCl: Um hidrogênio ionizável, logo produz um hidrônio;
- H2S: Dois hidrogênios ionizáveis, logo produzem dois hidrônios
b) Oxiácido
Em um oxiácido, só é considerado ionizável o hidrogênio que está ligado a um átomo de oxigênio na molécula. Para isso, é necessário construirmos a fórmula estrutural dele. Veja alguns exemplos:
-
H3PO4 (ácido fosfórico)
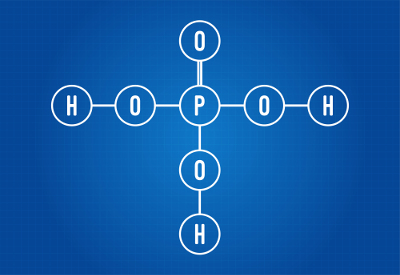
Fórmula estrutural do ácido fosfórico
Podemos observar que, na estrutura do ácido fosfórico, existem três hidrogênios ligados ao oxigênio, logo há três hidrogênios ionizáveis. A equação de ionização será:
H3PO4 + 3 H2O → 3 H3O+ + PO4-3
-
H2SO4 (ácido sulfúrico)
.jpg)
Fórmula estrutural do ácido sulfúrico
Podemos observar que, na estrutura do ácido sulfúrico, existem dois hidrogênios ligados ao oxigênio, logo há dois hidrogênios ionizáveis. A equação de ionização será:
H2SO4 + 2 H2O → 2 H3O+ + SO4-2
Por Me. Diogo Lopes Dias