Os compostos orgânicos são moleculares, ou seja, seus átomos realizam ligações covalentes entre si. Quando analisamos as ligações entre os carbonos, que podem ser simples, duplas ou triplas, observamos que elas são ligações apolares, pois não existe diferença de eletronegatividade entre os átomos, já que pertencem ao mesmo elemento.
Além disso, visto que o hidrogênio e o carbono possuem uma diferença de eletronegatividade muito pequena, as ligações entre eles também são apolares.
Ligações apolares:
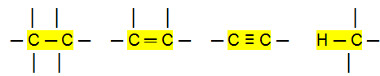
Com isso, podemos concluir que os hidrocarbonetos (compostos orgânicos que possuem somente átomos de carbono e hidrogênio) são moléculas apolares. Nesses compostos, a interação intermolecular é do tipo dipolo induzido, que é a mais fraca que existe.
Já que são fracas, torna-se fácil romper essas interações. Devido a isso, as temperaturas de ebulição e de fusão dos hidrocarbonetos são menores que as das outras funções.

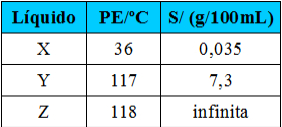
Comparando os hidrocarbonetos, os pontos de ebulição irão aumentar à medida que a massa molar também aumentar.
Por exemplo, o etano e o butano são ambos alcanos. Veja os pontos de ebulição de cada um determinados experimentalmente:
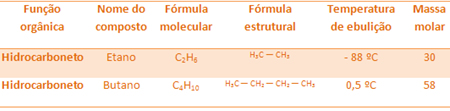
Observe que a temperatura de ebulição do butano é muito maior que a do etano, visto que a sua massa molar também é maior.
Agora quando comparamos hidrocarbonetos que possuem a mesma massa molar (são isômeros), mas que possuem tipos de cadeias carbônicas diferentes, percebemos que quanto maior o número de ramificações, menor será a temperatura de ebulição, porque a estrutura da molécula fica mais compacta, isto é, sua superfície diminui.
Todos os alcanos abaixo possuem a mesma fórmula molecular, C5H12, mas as suas temperaturas de ebulição são diferentes:
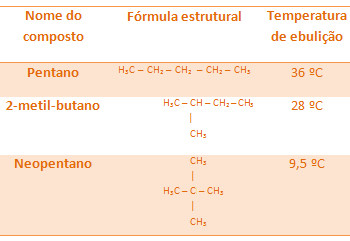
Veja que a temperatura de ebulição do neopentano é a menor, visto que ele possui mais ramificações.
Podemos considerar que as outras funções orgânicas são derivadas dos hidrocarbonetos, por meio da substituição de um ou mais hidrogênios por átomos ou grupos de átomos de outros elementos. Geralmente, as outras funções orgânicas possuem o oxigênio ou o nitrogênio, que são elementos mais eletronegativos que o carbono. Eles atraem com mais força o par de elétrons compartilhado com o carbono e, por isso, tornam a molécula polar:
Ligações polares:
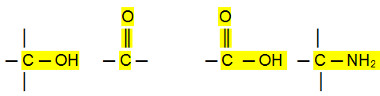
Os aldeídos, cetonas e haletos orgânicos possuem pontos de ebulição mais elevados que os hidrocarbonetos, porque a sua interação intermolecular é a dipolo permanente, que é mais forte que a de dipolo induzido.
Já os álcoois, ácidos carboxílicos e aminas possuem temperaturas de ebulição ainda mais altas, pois eles realizam ligações de hidrogênio, o tipo de interação intermolecular mais intenso.
Nos compostos de todas essas funções aplica-se o mesmo que vimos para os hidrocarbonetos:

Por Jennifer Fogaça
Graduada em Química