A massa molar e o número de mols são duas grandezas utilizadas no cotidiano de Química, em que a primeira faz referência à massa contida em 1 mol de determinada entidade elementar, enquanto a segunda é uma unidade para quantidade de matéria. Um mol contém, aproximadamente, 6,0 x 1023 entidades elementares, as quais podem ser átomos, íons, moléculas ou outras partículas.
A massa molar é também numericamente igual à massa atômica, por isso, pode ser determinada com base nos valores de massa que estão presentes na Tabela Periódica. Já o número de mols pode ser determinado com informações da matéria dentro do sistema, como massa, volume, número de partículas ou concentração.
Leia também: Como fazer cálculos estequiométricos
Tópicos deste artigo
- 1 - Resumo sobre massa molar e número de mol
- 2 - O que é massa molar e número de mol?
- 3 - Como calcular a massa molar e o número de mol?
- 4 - Relação entre massa molar e número de mol
- 5 - Exercícios resolvidos sobre massa molar e número de mol
Resumo sobre massa molar e número de mol
- A massa molar (MM) é a quantidade de massa referente a 1 mol de determinada entidade elementar.
- O número de mols (n) é a unidade do Sistema Internacional para a quantidade de matéria.
- Um mol contém, aproximadamente, 6,0 x 1023 entidades elementares.
- A massa molar é numericamente igual à massa atômica, portanto, pode ser determinada com base nos valores de massa contidos na Tabela Periódica.
- O número de mols, entretanto, pode ser determinado com base nas informações da substância no sistema, como massa, volume, número de partículas ou concentração.
- Massa molar e número de mols se relacionam entre si, pois o número de mols de uma substância é o quociente entre a sua massa presente no sistema e a sua massa molar.
O que é massa molar e número de mol?
Massa molar e número de mol são dois termos do cotidiano da Química. As definições oficiais desses termos, segundo a Iupac, são as seguintes:
- Massa molar (MM): é a quantidade de massa referente a 1 mol de determinada entidade elementar, ou seja, átomos, moléculas, íons, ou qualquer outra partícula ou grupo de partículas. Os valores de massa molar apresentam a unidade g/mol (ou g∙mol−1).
- Número de mols (n): é a unidade do Sistema Internacional (SI) para quantidade de matéria. Um mol contém, exatamente, 6,02214076 x 1023 entidades elementares. Esse número é correspondente à constante de Avogadro (NA) e, na maioria das vezes, é aproximado para 6,0 x 1023 a fim de simplificação de cálculos. Em um sistema, apresenta a quantidade específica de uma entidade elementar, que pode ser, por exemplo, átomo, molécula, elétron, íon, entre outras partículas ou grupo de partículas.
Como calcular a massa molar e o número de mol?
A massa molar é numericamente igual às massas atômicas e moleculares. Isso é consequência direta da aplicação da constante de Avogadro. Veja o exemplo a seguir:
|
1 átomo de oxigênio |
6 x 1023 átomos de oxigênio (1 mol de átomos de oxigênio) |
|
MA = 16 u |
MM = 16 g/mol |
|
1 átomo de hidrogênio |
6 x 1023 átomos de hidrogênio (1 mol de átomos de hidrogênio) |
|
MA = 1 u |
MM = 1 g/mol |
|
1 molécula de água |
6 x 1023 moléculas de água (1 mol de moléculas de água) |
|
M = 18 u |
MM = 18 g/mol |
Essa conversão permite, portanto, que a massa molar seja consultada, indiretamente, na Tabela Periódica, pois esta contém os valores das massas atômicas aproximadas de todos os elementos químicos conhecidos até então. Assim, caso, por exemplo, haja necessidade de se calcular a massa molar de alguma substância, deve-se recorrer à Tabela Periódica (ou qualquer outro local que tenha os valores de massas atômicas).
Exemplo: como calcular a massa molar da substância carbonato de potássio, K2CO3?
O potássio (K) apresenta uma massa atômica aproximada de 39 u e, assim, uma massa molar de 39 g/mol. O carbono apresenta uma massa atômica aproximada de 12 u e, desse modo, uma massa molar de 12 g/mol. Já o oxigênio apresenta uma massa atômica aproximada de 16 u e, dessa forma, uma massa molar de 16 g/mol. Portanto, a massa molar do carbonato de potássio pode ser calculada pela seguinte expressão:
MM(K2CO3) = 2 ∙ MM(K) + MM(C) + 3 ∙ MM(O)
MM(K2CO3) = 2 ∙ 39 + 12 + 3 ∙ 16
MM(K2CO3) = 78 + 12 + 48
MM(K2CO3) = 138 g/mol
Já a quantidade de mol de determinada espécie em um sistema poderá ser calculada por meio de algumas relações, de acordo com os dados e as condições desse sistema.
-
Cálculo do mol com base no número total de partículas
Quando o sistema apresenta o número total de partículas, pode-se chegar à quantidade de mol por meio da utilização da constante de Avogadro. Para tal, basta dividir o número de partículas pelo valor de 6,0 x 1023.
Por exemplo: quantos mols de moléculas de CO2 estão presentes em um sistema que contenha 2,4 x 1025 moléculas desse gás?
Para isso, basta que:
\(n = \frac{2,4 \ \cdot \ 10^{25} \ \text{moléculas}}{6,0 \ \cdot \ 10^{23} \ \text{moléculas}} = 40 \ \text{mol} \)
Também é possível utilizar a regra de três, já que, como cada mol contém 6,0 x 1023 moléculas de CO2, então, proporcionalmente, 2,4 x 1025 moléculas de CO2 correspondem a 40 mols de moléculas de CO2.
-
Cálculo do mol com base na massa de uma substância
Quando o sistema apresenta uma massa qualquer de uma substância, a quantidade de mols dessa substância pode ser alcançada por meio da utilização da massa molar (MM). Assim, deve-se dividir a quantidade de massa apresentada pela massa molar.
Por exemplo: quantos mols de de K2CO3 estão presentes em 34,5 gramas dessa substância?
Anteriormente, calculamos a massa molar do K2CO3 como 138 g/mol. Assim:
\(n = \frac{\text{massa}}{\text{massa molar}} = \frac{34,5}{138} = \frac{1}{4} = 0,25 \ \text{mol} \)
Da mesma forma, pode-se chegar ao número de mols por um cálculo de proporção, pois, como 138 gramas é a massa referente a 1 mol de K2CO3, então 34,5 gramas de K2CO3 apresentam uma quantidade igual a 0,25 mol dessa substância.
-
Cálculo do mol com base no volume de um gás (em CNTP)
O mol também pode ser calculado com base no volume de gás contido em um sistema. O próprio Avogadro estabeleceu que o volume ocupado por 1 mol de qualquer gás, nas condições normais de temperatura e pressão (CNTP, 0 °C ou 273 K e 1 atm de pressão), é igual a 22,4 L. Essa medida é conhecida como volume molar, ou seja, o volume correspondente a 1 mol de qualquer gás nas CNTP.
Portanto, tendo-se o volume de um gás nessas condições, deve-se dividir o volume por 22,4 L.
Por exemplo: quantos mols de gás oxigênio estão presentes em um volume de 112 L desse gás, medidos nas CNTP?
\(n = \frac{\text{volume}}{\text{volume molar}} = \frac{112}{22,4} = 5 \ \text{mol} \)
Assim como nos casos anteriores, uma proporção pode ser aplicada: como 1 mol de gás oxigênio, nas CNTP, ocupa um volume correspondente a 22,4 litros, então 5 mols desse gás, nas CNTP, ocupam um volume correspondente a 112 litros.
-
Cálculo do mol com base no volume de gás (fora das CNTP)
Quando o gás não se encontra nas CNTP, ou seja, com temperatura diferente de 0°C (ou 273 K) ou pressão diferente de 1 atm, deve-se utilizar a equação dos gases ideais (equação de Clapeyron), dada por:
PV = nRT
Em que P é a pressão, V é o volume, n é o número de mols, R é a constante dos gases ideais e T é a temperatura (sempre em Kelvin).
A constante dos gases ideais é dependente da unidade de pressão. Eis alguns valores, a depender da unidade da pressão:
|
Unidade de pressão |
Valor de R (aproximado) |
|
Atmosfera (atm) |
0,082 L.atm/mol.K |
|
Quilopascal (kPa) |
8,31 L.kPa/mol.K |
|
Milímetro de mercúrio (mmHg) |
62,3 L.mmHg/mol.K |
Por exemplo: calcule o número de mols de gás hidrogênio, sabendo que esse gás apresenta uma pressão equivalente a 2,0 atm, um volume igual a 8,2 L e que tais dados foram medidos em uma temperatura de 300 K.
\(PV = nRT \)
\(2 \cdot 8,2 = n \cdot 0,082 \cdot 300 \)
\(n = \frac{(2 \ \cdot \ 8,2)}{(0,082 \ \cdot \ 300)} = \frac{(2\ \cdot \ 100)}{300} = \frac{2}{3} \cong 0,67 \ \text{mol} \)
-
Cálculo do mol com base na concentração molar de uma solução
A concentração molar (M) de uma solução é definida como a quantidade de mols de soluto presente num determinado volume da solução, ou seja:
\(M = \frac{n}{V}\)
Portanto, é possível calcular o número de mols de determinado soluto por meio da expressão n = M ∙ V. Como a concentração molar apresenta unidade mol/L, a determinação do mol só será possível se o volume da solução estiver também em litros.
Por exemplo: quantos mols de NaOH estão presentes em uma solução dessa base, cujo volume é igual a 500 mL e a concentração é igual a 0,2 mol/L?
n = M ∙ V
n = 0,2 ∙ 0,5
n = 0,1 mol
Relação entre massa molar e número de mol
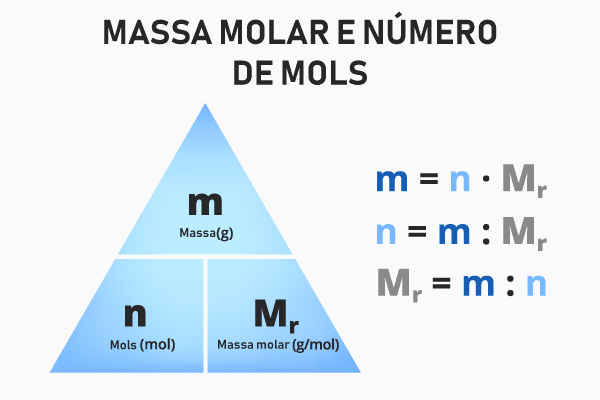
É bastante comum fazer uma relação entre massa molar e o número de mols, ou seja, no cotidiano dos estudos de Química, será comum utilizar a massa molar para a determinação do número de mols e vice-versa. Para se chegar a uma expressão que relacione essas duas grandezas, devemos partir do seguinte raciocínio.
A massa molar é a massa referente a 1 mol de determinada entidade elementar. Se for pensado um número de mols (n) qualquer, porém diferente de 1 mol, então essa entidade elementar terá uma massa (m), em gramas, totalmente diferente, porém proporcional à sua massa molar:
|
MM (g/mol) |
--------------------------- |
1 mol |
|
m (g) |
--------------------------- |
n (mol) |
Resolvendo-se essa regra de três, temos que:
MM ∙ n = m
Ou seja:
\(n = \frac{m}{MM} \)
Por isso, para se determinar o número de mols de qualquer substância, basta utilizar a massa dessa substância contida no sistema e dividir pelo valor de sua massa molar.
Leia também: Massa molecular — forma criada para calcular a massa de uma molécula com base nas massas atômicas
Exercícios resolvidos sobre massa molar e número de mol
Questão 1
(Fameca/2019) A análise da água da chuva de uma região metropolitana indicou a presença de 1,728 mg de íons SO42– por litro.
O número de mols de íons SO42– existente em 200 litros de água recolhidos dessa chuva é igual a
A) 9,0 × 10–5.
B) 1,8 × 10–6.
C) 1,8 × 10–3.
D) 3,6 × 10–6.
E) 3,6 × 10–3.
Resposta: Letra E
A massa molar do ânion SO42− é calculada da seguinte forma:
MM(S) + 4 \(\cdot\) M(O) = 32 + 4 \(\cdot\) (16) = 96 g/mol.
Vale lembrar que os elétrons têm massa desprezível, portanto, não influenciam na massa molar.
Se a análise indicou a presença de 1,728 mg desse ânion por litro, em 200 litros existem 345,6mg (0,3456g) desse ânion proporcionalmente.
O número de mols é calculado então pela expressão:
\(n = \frac{m}{MM} = \frac{0,3456}{96} = 0,0036 = 3,6 \times 10^{-3} \ \text{mols} \)
Questão 2
(Famerp/2019) Em janeiro de 2018 foi encontrado em uma mina na África o quinto maior diamante (uma variedade alotrópica do carbono) do mundo, pesando 900 quilates. Considerando que um quilate equivale a uma massa de 200 mg, a quantidade, em mol, de átomos de carbono existente nesse diamante é igual a
A) 1,5 × 101.
B) 3,0 × 101.
C) 4,5 × 101.
D) 1,5 × 104.
E) 3,0 × 104.
Resposta: Letra A
O diamante tem 900 quilates e cada quilate equivale a uma massa de 200mg. Assim, tal diamante apresenta uma massa de 180 x 103 mg ou 180g.
O diamante é uma forma alotrópica do carbono, C, portanto, a massa molar é de 12 g/mol.
Assim, o número de mols pode ser calculado pela expressão:
\(n = \frac{m}{MM} = \frac{180}{12} = 15 = 1,5 \times 10^1 \ \text{mols} \)
Fontes
HAYNES, W. M. (ed.) CRC Handbook of Chemistry and Physics. 95a ed. CRC Press: 2014.
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY – IUPAC. Glossary of terms used in physical organic chemistry. Pure and Applied Chemistry, Reino Unido, 1994.