No texto “Eletrólise Ígnea”, explicou-se que esse processo ocorre quando se passa uma corrente elétrica numa substância fundida (no estado líquido), sem a presença de água e, dessa forma, o cátion recebe elétrons e o ânion doa elétrons, para que ambos fiquem com carga elétrica igual a zero e com energia acumulada.
Para compreender melhor como a eletrólise ígnea ocorre, vamos considerar um dos mais importantes exemplos desse tipo de processo, a eletrólise do cloreto de sódio ou sal de cozinha (NaCl).
O cloreto de sódio se forma na natureza por meio da transferência de um elétron do sódio (Na) para o cloro (Cl), conforme a reação abaixo:
2Na(s) + 1Cl2(g) → 2NaCl(s)

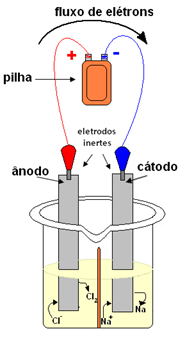
Esse processo é espontâneo, mas o processo inverso dessa reação não é espontâneo, ou seja, a produção do gás cloro (Cl2(g) – figura abaixo) e do sódio metálico (Na(s)) não ocorre na natureza. Se quisermos que isso ocorra, teremos que iniciar o processo.
Isso pode ser feito pela eletrólise ígnea. O sal é aquecido a uma temperatura superior a 800,4ºC, que é o seu ponto de fusão; e, dessa forma, ele se funde, passando do estado sólido para o líquido. Nesse estado físico, os seus íons Na+ e Cl- ficam livres.
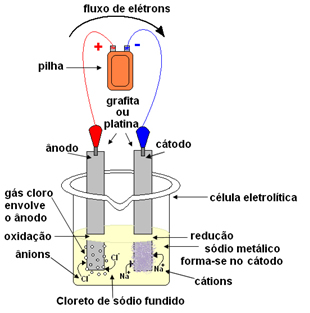
O sal fundido é então colocado em um recipiente, a cuba eletrolítica, e dois eletrodos inertes de platina ou de grafite são mergulhados no cloreto de sódio. Esses eletrodos são ligados a uma fonte geradora de corrente elétrica contínua, como uma bateria ou uma pilha.
Com a passagem de corrente elétrica, acontece o seguinte:
- O polo negativo da bateria ou pilha fornece elétrons para um dos eletrodos, que se torna o cátodo;
- Cátodo: recebe os elétrons da pilha e se torna o polo negativo, atraindo os cátions Na+, pois cargas opostas se atraem. Esses íons recebem os elétrons do eletrodo (cátodo) e ocorre a sua redução, formando sódio metálico:
Redução: Na+(ℓ) + e- → Na(s)
O sódio metálico vai se depositando na parte de cima do eletrodo e é encaminhado a um reservatório.
- Ânodo: fica carregado positivamente, atraindo os ânions Cl- (por isso, chama-se ânodo). Esses íons perdem seus elétrons ao entrarem em contato com o ânodo e, por isso, sofrem oxidação, formando átomos de cloro, que imediatamente se combinam de dois a dois formando o gás cloro:
Oxidação: 2Cl-(ℓ) → 2 e- + 1Cl2(g)
Esse gás fica borbulhando ao redor do ânodo e é recolhido por um tubo de vidro adaptado ao sistema.
Assim, a reação global que ocorre nesse caso é dada por:
Cátodo: 2Na+(ℓ) + 2e- → 2Na(s)
Ânodo: 2Cl-(ℓ) → 2 e- + 1Cl2(g)____________
Reação Global: 2Na+(ℓ) + 2Cl-(ℓ) → 2Na(s) + 1Cl2(g)
Outro aspecto importante a que se deve estar atento e que foi salientado no final do texto mencionado (Eletrólise ígnea), é que, para que a eletrólise ocorra, a pilha ou bateria usada para gerar a corrente elétrica deve ter uma ddp (diferença de potencial) igual ou maior que a diferença de potencial da reação.
Vejamos isso no caso da eletrólise do cloreto de sódio que estamos considerando. Para descobrir a diferença de potencial dessa reação, basta diminuir o potencial-padrão de redução do cátodo pelo o do ânodo. Isso é explicado no texto Diferença de potencial de uma pilha .
Por meio da tabela de potenciais-padrão de redução (E0red), sabemos que:
Na+(ℓ) + e- → Na(s) E0red= -2,71
2Cl-(ℓ) → 2 e- + 1Cl2(g) E0red= +1,36
Agora, basta diminuir esses valores para saber a diferença de potencial da reação global:
∆E0 = E0red(cátodo) - E0red(ânodo)
∆E0 = -2,71 – (+ 1,36)
∆E0 = - 4,07 V
Portanto, isso significa que a pilha ou bateria que será usada precisa ter a voltagem igual ou maior que 4,07V para realizar a eletrólise ígnea do cloreto de sódio.
O valor negativo apenas indica que se trata de um processo não espontâneo. No caso das pilhas, que se trata de um processo espontâneo, o valor de força eletromotriz (∆E0) sempre dá positivo.
Por Jennifer Fogaça
Graduada em Química