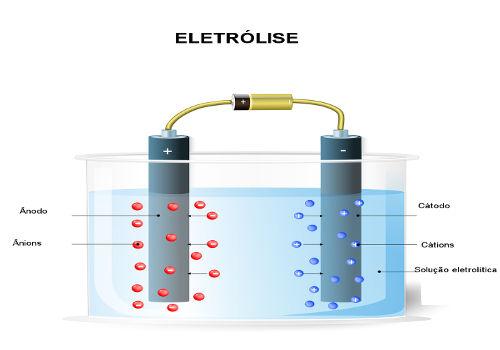
Conceito de eletrólise
O conceito de eletrólise refere-se aos processos químicos provocados, isto é, artificiais, que se baseiam na passagem de corrente elétrica por um sistema líquido com presença de íons.

Videoaulas

(Unifor-CE) As proposições a seguir estão relacionadas com eletrólise:
I. As reações de eletrólise ocorrem com consumo de energia elétrica.
II. Soluções aquosas de glicose não podem ser eletrolisadas porque não conduzem corrente elétrica.
III. Nas eletrólises de soluções salinas, os cátions metálicos sofrem oxidação.
Podemos afirmar que apenas:
a) I é correta.
b) II é correta.
c) III é correta.
d) I e II são corretas.
e) II e III são corretas.
(UFRS) Na eletrólise de nitrato de ferro II, em solução aquosa, ocorre:
a) redução no polo negativo com formação de ferro metálico.
b) oxidação no polo negativo com liberação de gás oxigênio.
c) redução no polo positivo com liberação de gás oxigênio.
d) oxidação no polo positivo com formação de gás NO2.
e) redução no polo negativo com formação de gás hidrogênio.
(FEI-SP) Dois alunos de Química realizaram eletrólise do BaCl2; a primeira aquosa e, a segunda, ígnea. Com relação ao resultado, podemos afirmar que ambas obtiveram:
a) H2 e O2 nos ânodos.
b) H2 e Ba nos ânodos.
c) Cl2 e Ba nos eletrodos.
d) H2 nos cátodos.
e) Cl2 nos ânodos.
Assinale a alternativa correta sobre a eletrólise:
a) A reação que ocorre no cátodo é de oxidação.
b) A reação que ocorre no ânodo é de redução.
c) O cátodo fornece elétrons dos cátions do eletrólito e tem sinal positivo.
d) O ânodo recebe elétrons dos ânions do eletrólito e tem sinal positivo.
e) Na eletrólise, a energia química é transformada em energia elétrica.