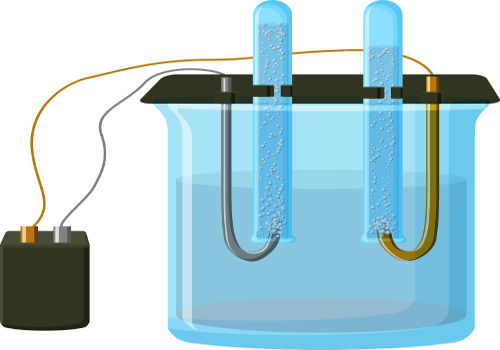
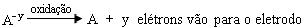A eletrólise é um método usado para obter reações de óxido-redução. Em soluções eletrolíticas, o processo se baseia na passagem de uma corrente elétrica através de um sistema líquido que tenha íons presentes, gerando assim reações químicas.
As reações na eletrólise podem ocorrer de várias maneiras, depende do estado físico em que estiver a solução que vai ser submetida à reação: pode estar liquefeita (fundida) ou em solução aquosa. Elas se classificam em eletrólise ígnea e semi-reação (catódica ou anódica).
Tópicos deste artigo
Eletrólise ígnea
É a eletrólise de um eletrólito no estado fundido. O material, antes de ser eletrolisado, é aquecido até a fusão (vira líquido). Esse processo é necessário, e veja o porquê: o sólido iônico deve ser liquefeito por aquecimento (fusão), pois no estado líquido os íons têm livre movimento para facilitar a deslocagem até os eletrodos e, aí então, se descarregarem.
Exemplo:
Eletrólise ígnea do NaCl. Inicialmente vamos derreter o NaCl (s).
NaCl (s) → Na+ (l) + Cl- (l)
Haverá a ocorrência de duas semi-reações:
Cátodo (-) Na+ + é → Na
Ânodo (+) Cl → é 0,5 Cl2
Somando–se algebricamente os três processos ocorridos, temos:
NaCl → Na+ + Cl-
Na+ + é → Na
Cl- → é + 0,5 Cl2
______________
NaCl → Na + 0,5 Cl2
A eletrólise ígnea do NaCl produz sódio metálico e gás cloro. Observe que neste processo não há presença da água, sendo assim não haverá íons H+ e OH- no sistema.
Semi-reação catódica
Os cátions são atraídos pelo cátodo e sofrem redução, isto é, recebem elétrons do eletrodo.
Equação geral:
Exemplos:
Ag+ + e- = Ag
Zn2+ + 2e- = Zn
Al3+ + 3e- = Al
2 H+ + 2e- = H2
Semi-reação anódica
Os ânions são atraídos pelo ânodo e sofrem oxidação, isto é, cedem elétrons ao eletrodo.
Equação geral:
Exemplos:
2 Cl- → 2e- + Cl2
2 F- → 2e- + F2
2 Br- → 2e- + Br2
Por Líria Alves
Graduada em Química