Eletrólise é todo processo químico não espontâneo provocado por corrente elétrica.
Substâncias iônicas possuem a capacidade de conduzir corrente elétrica quando estão em soluções aquosas. A eletrólise provém dessa propriedade iônica, ou seja, é um processo que se baseia na descarga de íons, no qual ocorre uma perda de carga por parte de cátions e ânions.
Temos dois tipos de eletrólise: eletrólise ígnea e eletrólise aquosa. A diferença entre elas é que uma ocorre em substância iônica no estado de fusão e outra em solução aquosa. Vejamos:
Eletrólise ígnea: Ocorre em altas temperaturas e na ausência de água. Nesse tipo de eletrólise o sólido iônico deve estar liquefeito por aquecimento (fusão), para os íons se deslocarem com mais facilidade até os eletrodos e aí se descarregarem. Isso se explica porque no estado líquido os íons têm livre movimento.
Eletrólise aquosa: Nesse caso existem os íons resultantes da dissociação iônica do eletrólito e os íons do meio aquoso que também participam do processo. Esses últimos são íons, no caso cátions H+ e ânions OH-, provenientes da auto-ionização da água.
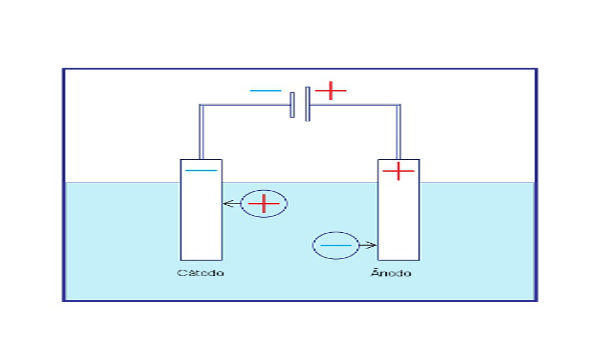
Processo básico de funcionamento da eletrólise:
A eletrólise ocorre em cubas (ou celas) eletrolíticas, com dois eletrodos ligados aos terminais de um gerador de corrente contínua.
Cátodo: É o eletrodo negativo que atrai cátions, e é nele que ocorre a redução do cátion.
Ânodo: O eletrodo positivo que atrai ânions e, por isso, é aqui que se dá a oxidação do ânion.
Nesse processo, os elétrons emergem da pilha (gerador) pelo ânodo (-) e entram na cela eletrolítica pelo cátodo (+), no qual produz a redução, e a oxidação ocorre quando os elétrons emergem pelo ânodo e chegam à pilha pelo cátodo.
Por Líria Alves
Graduada em Química