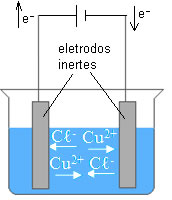
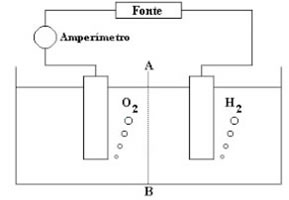
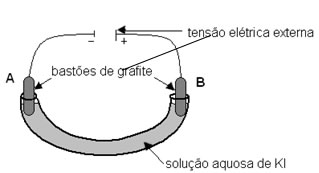
A eletrólise em meio aquoso é uma reação de oxirredução não espontânea que ocorre com pela passagem de corrente elétrica por meio de uma solução de íons dissolvidos em água. Para entendê-la bem, é importante saber o que é a eletrólise em sim. Acompanhe!
Veja também: O que é eletrólise ígnea?
Tópicos deste artigo
- 1 - O que é eletrólise e para que serve?
- 2 - Eletrólise aquosa
- 3 - Como ocorre a eletrólise aquosa
- 4 - Exercícios resolvidos
O que é eletrólise e para que serve?
Eletrólise é o nome dado à reação química de oxirredução que ocorre provocada pela passagem de corrente elétrica. Essa reação pode acontecer de duas formas: a eletrólise ígnea e a eletrólise em solução iônica aquosa. Sendo essa última de nosso interesse neste texto.
Nos dois tipos de eletrólise existem íons, a diferença é que, no primeiro tipo, o composto iônico é fundido e não possui água no processo, e, já no segundo, como o próprio nome diz, o composto iônico está dissolvido em água.
A eletrolise é um processo químico utilizado para a obtenção de elementos químicos (como metais, hidrogênio, berílio, cloro, entre outros), para o processo de galvanização, como cromagem e niquelagem, e também para a purificação eletrolítica de metais. Caso tenha curiosidade sobre esse tópico, leia nosso texto: Conceito de eletrólise.

Eletrólise aquosa
Na eletrólise aquosa, temos um composto iônico dissolvido em água, e esse, por dissociação ou ionização, libera seus íons na solução, possibilitando a passagem de corrente elétrica. Além dos íons liberados pelo composto iônico, devemos levar em consideração os íons provenientes da autoionização da água:
H2O → H+ + OH-
Por haver a necessidade da corrente elétrica para que ocorra a eletrólise, dizemos, então, que se trata de um processo não espontâneo. O qual ocorre exatamente ao contrário do processo visto em uma pilha, que, por sua vez, transforma a energia química derivada de uma reação, para a produção de energia elétrica.
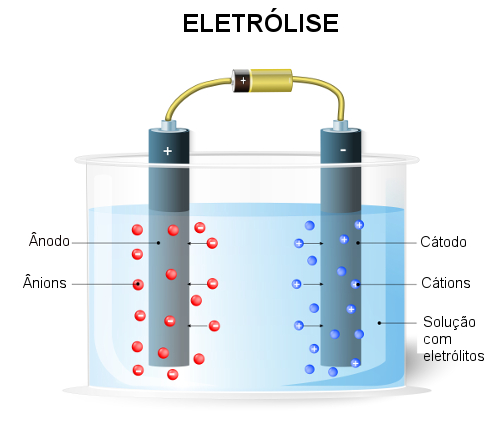
Como ocorre a eletrólise aquosa
Como já dito, durante a eletrólise aquosa, devemos levar em consideração os íons derivados da água e os íons derivados do composto dissolvido. Veja o exemplo da dissociação do cloreto de sódio:
NaCl(aq) → Na+(aq) + Cl-(aq)
Assim a solução passa a ter dois cátions (H+ e Na+) e dois ânions (OH- e Cl-). No entanto, apenas um cátion e um ânion sofrerão oxirredução pela descarga elétrica. Para identificar qual dos dois será afetado, temos uma fila de prioridade, representada, a seguir, na ordem crescente:
- Cátions: Metais da família 1,2 e 13 < H+ < outros metais
- Ânions: Ânions oxigenados e F- < OH- < ânions não oxigenados
Portanto, para o exemplo da eletrólise em solução aquosa de cloreto de sódio, temos que os íons H+ e Cl- sofrerão descarga elétrica. Agora, faremos a análise do que ocorre em cada um dos polos:
-
Cátodo e ânodo
No cátodo, o polo negativo da cela eletrolítica, os elétrons chegam ao eletrodo e é para onde migram os cátions presentes na solução. Portanto, é onde ocorre a descarga do cátion H+ e sua redução, conforme a equação seguinte:
2H+ + 2e → H2(g)
No ânodo, o polo positivo da cela eletrolítica, os cátions presentes na solução sofrem a descarga e perdem seus elétrons. Por ter prioridade de descarga sobre o OH-, o Cl- migra para a o ânodo, onde sofre oxidação conforme a equação seguinte:
2Cl-(aq) → 2e + Cl2(g)
Podemos escrever a equação geral do processo de eletrólise somando as reações de cada etapa do processo: a dissociação; a autoionização da água; a redução do cátion; e a oxidação do ânion.
NaCl(aq) → Na+(aq) + Cl-(aq)
H2O → H+ + OH-
2H+ + 2e → H2(g)
2Cl-(aq) → 2e + Cl2(g)
Balanceando as equações e eliminando os itens que se repetem nos reagentes e nos produtos, temos:
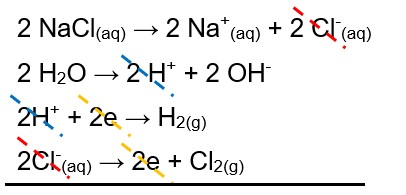
2NaCl(aq) + 2H2O(liq.) → 2Na+(aq) + 2OH-(aq) + H2(g) + Cl2(g)
Analisando a equação global, temos ainda em solução os íons Na+(aq) e OH-(aq), formando soda cáustica (NaOH), um dos produtos da reação, além do gás hidrogênio, formado no cátodo, e do gás cloro, formado no ânodo.
Veja também: Aspectos quantitativos da eletrólise
Exercícios resolvidos
Questão 01 (UEG) A galvanização é um processo que permite dar um revestimento metálico a determinada peça. A seguir é mostrado um aparato experimental, montado para possibilitar o revestimento de uma chave com níquel.
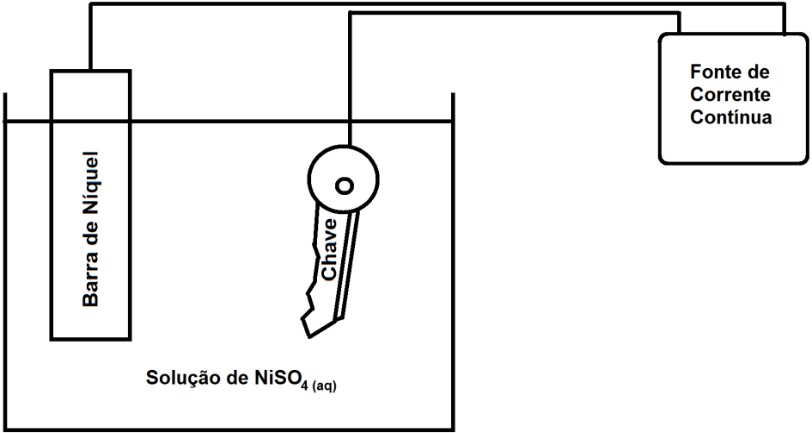
No processo de revestimento da chave com níquel ocorrerá, majoritariamente, uma reação de X, representada por uma semirreação Y. Nesse caso, o par XY pode ser representado por:
a) redução, Ni+ + 1e– → Ni(s)
b) redução, Ni(s) → Ni2+ + 2e–
c) oxidação, Ni2+ + 2e– → Ni(s)
d) oxidação, Ni(s) → Ni2+ + 2e–
e) redução, Ni2+ + 2e– → Ni(s)
Resolução: Letra “e”. Os íons presentes na solução são: cátions: Ni2+ e H+; ânions: SO42- e OH-. Para os cátions, o Ni2+ tem prioridade na descarga e, portanto, sofrerá redução no cátodo, conforme a equação: Ni2+ + 2e– → Ni(s).
Questão 02 (FMABC-SP) Considere o seguinte sistema utilizado na purificação de cobre metálico:
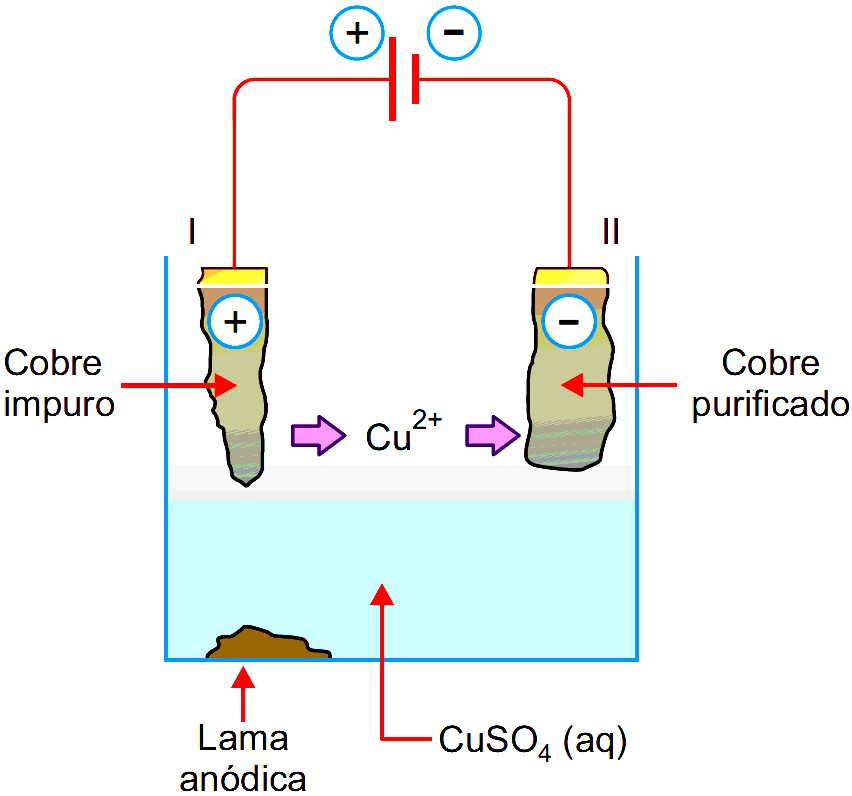
Nesse processo:
a) II representa o cátodo em que ocorre a oxidação.
b) II representa o ânodo em que ocorre a redução.
c) I representa o cátodo em que ocorre a oxidação.
d) I representa o cátodo em que ocorre a redução.
e) I representa o ânodo em que ocorre a oxidação.
Resolução: Letra “e”. Na eletrólise, o eletrodo ligado ao polo positivo do gerador é chamado de ânodo, e nele os ânions perdem elétrons e sofrem oxidação, conforme a equação: Cu0 → Cu2+ + 2e.
Questão 03 (Fatec-SP) Para a cromação de um anel de aço, um estudante montou o circuito eletrolítico, representado na seguinte figura, utilizando uma fonte de corrente contínua.
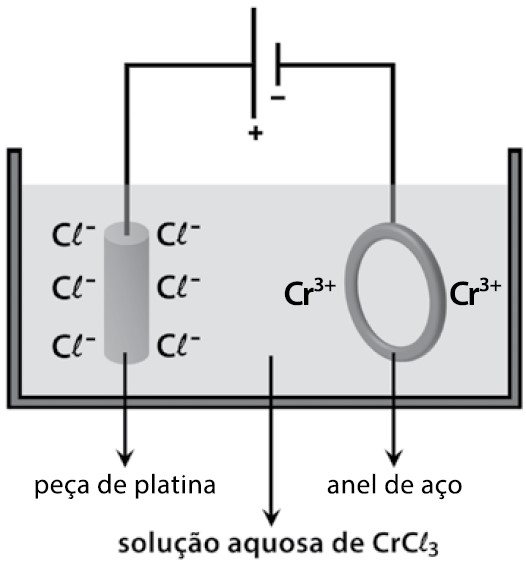
Durante o funcionamento do circuito, é correto afirmar que nele ocorre
a) liberação de gás cloro no ânodo e depósito de cromo metálico no cátodo.
b) liberação de gás cloro no cátodo e depósito de cromo metálico no ânodo.
c) liberação de gás oxigênio no ânodo e depósito de platina metálica no cátodo.
d) liberação de gás hidrogênio no ânodo e corrosão da platina metálica no cátodo.
e) liberação de gás hidrogênio no cátodo e corrosão do aço metálico no ânodo.
Resolução: Letra “a”. Os íons presentes na solução são: cátions: Cr3+ e H+; ânions: Cl- e OH-. Para os cátions, o Cr3+ tem prioridade na descarga e, portanto, sofrerá redução no cátodo, conforme a equação: Cr3+ + 3e– → Cr(s).
Para os ânions, o Cl- tem prioridade na descarga e, portanto, sofrerá oxidação no ânodo, conforme a equação: 2Cl-(aq) → 2e + Cl2(g).
Ou seja, no ânodo (peça de platina) teremos a liberação do gás cloro Cl2, e, no cátodo (anel de aço), a deposição do cromo metálico.
Por Victor Ferreira
Professor de Química