Normalmente, as reações de eletrólise em meio aquoso e eletrólise ígnea são realizadas com eletrodos de grafite e de platina, que não participam da reação; apenas conduzem a corrente elétrica. Porém, existem alguns casos específicos, em que é necessário o uso de eletrodos ativos, ou seja, que sofrem redução e oxidação.
Os principais casos de uso desses eletrodos que participam do processo de oxirredução são: a purificação eletrolítica de metais, como o zinco, cobalto, níquel e, principalmente, o cobre; e também a galvanoplastia. Vejamos como ocorre cada caso:
• Purificação Eletrolítica do Cobre: esse refino eletrolítico do cobre consegue produzir uma pureza de cerca de 99,9% e é usado, principalmente, para fazer fios de cobre que, se tiverem o mínimo de impureza, podem ter a sua capacidade de conduzir a corrente elétrica muito diminuída.
Observe como esse processo ocorre, vendo o esquema de uma cuba eletrolítica montado abaixo:
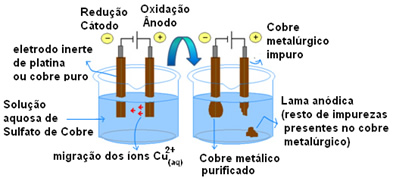
É aplicada uma diferença de potencial na solução aquosa de Sulfato de Cobre (CuSo4(aq)) – que é condutora de eletricidade – para que o ânodo, que é um cobre metálico impuro, perca elétrons, ou seja, sofra oxidação, liberando seus cátions (Cu2+), que se depositam na placa negativa. Essa pode ser uma placa inerte de platina, ou, o que é melhor, uma placa pura de cobre. Ela constitui o cátodo, que se reduz, pois o cobre se deposita nela. Desse modo, as semirreações que ocorrem nos eletrodos são:
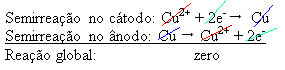
O fato de ter dado resultado zero indica que não houve uma reação química, mas apenas o transporte de cobre. No fundo do recipiente se encontram as outras substâncias impuras que estavam no cobre como ouro, prata, sílica (areia) e outros minérios, que podem até ser vendidos.
• Galvanoplastia: é aplicado um revestimento metálico sobre um material que se deseja proteger de corrosão.
O metal escolhido para o revestimento – que pode ser o cromo (cromeação), níquel (niquelação), a prata (prateação), o ouro (douração) ou o zinco (galvanização) – será o ânodo, eletrodo positivo, que sofre oxidação, perdendo elétrons. Ele sofre oxidação no lugar do material que foi protegido, porque seu potencial de redução é maior.
Já o eletrodo negativo, isto é, o cátodo, que recebe esses elétrons e sofre redução, é o próprio material que foi revestido. Dessa forma, ele se mantém protegido mesmo se sua superfície for de alguma forma violada.
Por Jennifer Fogaça
Graduada em Química
