O alumínio é obtido por meio de processos metalúrgicos. A metalurgia é uma área que estuda a transformação de minérios em metais ou em ligas metálicas. Vários metais são obtidos por esse método, tais como o cobre, o titânio, o ferro e o manganês.
No caso do alumínio, o principal minério utilizado é a bauxita (figura), que contém óxido de alumínio hidratado (Aℓ2O3 . x H2O) e diversas impurezas.

Na metalurgia do alumínio, ocorrem as quatro etapas a seguir:
Quando o óxido de alumínio (Aℓ2O3(s)) é separado da bauxita, seu nome passa a ser alumina.
Antigamente, fazia-se o seguinte: tratava-se a alumina com ácido clorídrico, para gerar o cloreto de alumínio; que era colocado para reagir com potássio ou sódio metálicos, causando a redução do composto e originando o alumínio metálico:
Aℓ2O3(s) + 6 HCℓ(aq)→ 4 AℓCℓ3(aq) + 3 H2O(ℓ)
AℓCℓ3(aq) + 3 K(s)→ 3 KCℓ(s) + Aℓ(s)
Entretanto, esse método era muito caro e ineficiente, por isso o alumínio era considerado um metal raro.
Mas, em 1886, dois cientistas de modo separado desenvolveram o método citado acima, em que se utilizava a eletrólise ígnea. Esses cientistas eram o americano Charles M. Hall e o francês Paul Héroult, por isso esse método passou a ser chamado de Processo de Hall-Héroult ou, simplesmente, Processo de Hall, visto que Charles M. Hall o patenteou.
O ponto chave que eles descobriram era como fazer o óxido de alumínio ficar no estado líquido para assim conseguir realizar a sua eletrólise ígnea, pois o problema era que o ponto de fusão dele era acima de 2000ºC. Eles utilizaram um fundente, o minério criolita (Na3AℓF6), que foi capaz de abaixar a temperatura de fusão do óxido de alumínio para cerca de 1000 ºC.
Assim, como mostra o esquema abaixo, essa mistura de óxido de alumínio e criolita foi colocada em uma cuba eletrolítica de aço revestida de carbono. Por essa mistura fundida passa uma corrente elétrica. As paredes do recipiente que ficam em contato com a mistura funcionam como polo negativo da eletrólise (cátodo), onde ocorre a redução dos cátions de alumínio. Já o ânodo (polo positivo) são cilindros constituídos de grafite ou de carvão, isto é, ambos formados de carbono, onde ocorre a oxidação dos ânions de oxigênio:
Semirreação do cátodo: 4 Aℓ3+(ℓ) + 12 e- → 4 Aℓ(ℓ)
Semirreação do ânodo: 6 O2-(ℓ) → 12 e- + 3 O2(g)
O oxigênio formado reage com o carbono do ânodo e gera também dióxido de carbono:
3 O2(g) + 3 C(s) → 3 CO2(g)
De modo que a reação global e o esquema dessa eletrólise ígnea que dá origem ao alumínio são dados por:
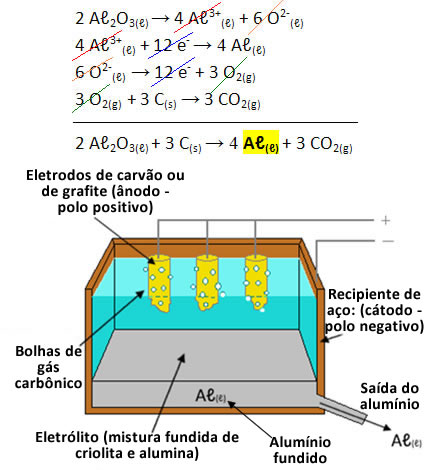
O alumínio obtido está na forma líquida, porque o seu ponto de fusão é de 660,37 ºC, ou seja, menor que o da mistura de alumina e criolita. O alumínio também é mais denso que a mistura e, por isso, vai se depositando no fundo do recipiente, por onde é recolhido.
Na produção de 1 tonelada de alumínio usa-se:
- 4 a 5 toneladas de bauxita, de onde são extraídas cerca de 2 toneladas de alumina;
- 50 quilogramas de criolita (não há muitas reservas naturais de criolita, por isso, ela costuma ser obtida por meio de sua síntese a partir da fluorita (CaF2), um mineral mais abundante na natureza);
- 0,6 toneladas de carvão para os eletrodos.
Anualmente a produção de alumínio ultrapassa 27,4 milhões de toneladas.
Entre as principais ligas metálicas do alumínio, temos as seguintes:

Por Jennifer Fogaça
Graduada em Química

