O rádio, símbolo Ra, número atômico 88, é o mais pesado dos metais alcalinoterrosos conhecidos até então. Ele é muito radioativo e, por isso, bastante perigoso. O rádio aparece em minérios de tório e urânio, pois é formado durante a desintegração radioativa desses elementos. Seu isótopo mais estável é o 226, com 1599 anos de meia-vida.
O rádio foi descoberto pelo célebre casal Pierre e Marie Curie, no começo do século XX. Os estudos acerca desse elemento impulsionaram o campo da radioatividade, fazendo com que Pierre ganhasse um prêmio Nobel em 1903 e Marie ganhasse dois prêmios Nobel, em 1903 e em 1911. Atualmente, o rádio é utilizado na medicina para o tratamento de alguns tipos de câncer e também na obtenção da liga metálica berílio-rádio.
Tópicos deste artigo
- 1 - Resumo sobre rádio
- 2 - Propriedades do rádio
- 3 - Características do rádio
- 4 - Onde o rádio pode ser encontrado?
- 5 - Obtenção do rádio
- 6 - Aplicações do rádio
- 7 - Precauções com o rádio
- 8 - História do rádio
- 9 - Exercícios sobre rádio
Resumo sobre rádio
-
É um metal alcalino-terroso do sétimo período da Tabela Periódica.
-
Em sua forma metálica, apresenta coloração branca e brilhante.
-
Apresenta luminescência, emitindo um intenso brilho verde.
-
Apesar de ter mais de 30 isótopos conhecidos, apenas quatro ocorrem naturalmente.
-
É encontrado em minérios de tório e urânio, pois é produzido durante a desintegração desses elementos.
Anuncie aqui -
Tem aplicação na medicina, para o tratamento de alguns tipos de câncer.
-
Foi descoberto por Pierre e Marie Curie, cujos estudos sobre o elemento permitiram que o casal ganhasse o prêmio Nobel de Física em 1903 e que Marie fosse laureada com o Nobel de Química em 1911.
Propriedades do rádio
-
Símbolo: Ra
-
Número atômico: 88
-
Massa atômica: 226,025 u.m.a
-
Eletronegatividade: 0,89
Anuncie aqui -
Ponto de fusão: 696 °C
-
Ponto de ebulição: 1140 °C
-
Densidade: 5,0 g.cm-3
-
Configuração eletrônica: 7s2
-
Série química: grupo 2, metais alcalinoterrosos
Características do rádio

O rádio é o mais pesado dos metais alcalinoterrosos, com número atômico 88. É um elemento radioativo que, na sua forma metálica, apresenta uma coloração branca e brilhante, mas que logo se torna mais escura por ser oxidado em contato com o ar, formando, provavelmente, o nitreto de rádio (Ra3N2). O rádio e seus sais apresentam luminescência, ou seja, emitem luz ao serem instigados por algum estímulo, como uma radiação eletromagnética.
O rádio é capaz de reagir com a água, formando o hidróxido de rádio, Ra(OH)2, com produção de H2. Seus sais — RaSO4, RaCl2, RaBr2 e Ra(NO3)2 — são os menos solúveis entre os metais alcalinoterrosos. Contudo, o hidróxido é o mais solúvel e de maior alcalinidade dentro do grupo. Quando posto em uma chama, o rádio e seus compostos produzem uma luz vermelha, similar aos compostos de estrôncio.
Em termos de radioatividade, o rádio comumente emite partículas alfa, beta e raios gama e, quando misturado ao berílio, produz nêutrons. A quantidade de 1,0 g de rádio é capaz de produzir 3,7 x 1010 desintegrações por segundo. A antiga unidade Curie (Ci) — hoje substituída pela Becquerel (Bq) — é definida, inclusive, como a quantidade de radioatividade que possui a mesma taxa de desintegração dessa grama de rádio. O gás nobre radônio é produzido também de um grama de rádio. Nesse processo, 0,00001 mL do gás é liberado.
-
Videoaula sobre radioatividade
Onde o rádio pode ser encontrado?
Existem mais de 30 isótopos conhecidos do rádio, os quais ajudam a compor o teor estimado de 1 ppt (parte por trilhão, 1 ng.kg-1) desse elemento na crosta terrestre. Desses, apenas quatro são encontrados na natureza:
-
226Ra
-
228Ra
Anuncie aqui -
224Ra
-
223Ra
Entre eles, apenas os dois primeiros têm meia-vida maior do que um ano, sendo 1599 anos para o de massa 226 e 5,76 anos para o de massa 228. Todos eles são intermediários de séries de decaimentos radioativos famosas. O 226Ra, por exemplo, está na série de decaimento do 238U. Já os isótopos 228Ra e 224Ra estão na série de decaimento do 232Th. Por fim, o 223Ra está presente na série de decaimento do 235U.
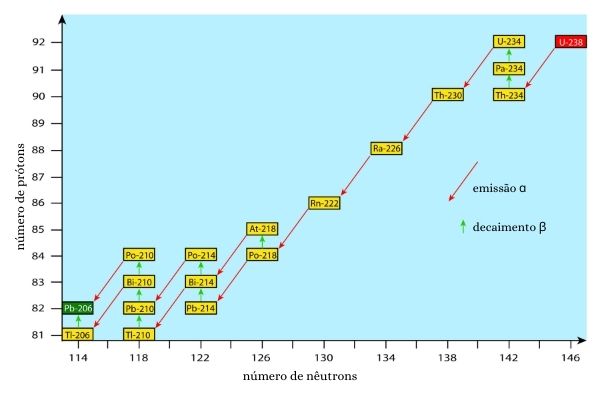
Obtenção do rádio
Os isótopos naturais do rádio acompanham minérios de urânio e tório. Nesse caso, a sua obtenção parte do processamento desses minerais, que envolve etapas de enriquecimento (no sentido de eliminar impurezas e aumentar o teor dos elementos desejados) e depois de solubilização via lixiviação (lavagem) ácida ou básica.
Na lixiviação, vários precipitados são formados, sendo que o rádio precipita junto ao bário na forma de sulfato (se a lixiviação for ácida) ou de carbonato (se a lixiviação for básica). Os sulfatos de rádio e bário são então reduzidos a sulfetos por ação do carbono e dissolvidos em água, isso auxilia na separação dos demais, que formam sulfetos insolúveis e são separados.
Por fim, pode-se obter um composto de rádio pela técnica de cristalização fracionada (em que os compostos são separados em função das diferenças de solubilidade). Por exemplo, utiliza-se ácido clorídrico seguido de evaporação para que tanto o bário quanto o rádio sejam convertidos em cloretos. A cristalização fracionada permite a obtenção isolada do cloreto de rádio. O bário metálico pode então ser obtido via eletrólise.
Leia mais: O que é eletrólise?
Aplicações do rádio
Atualmente o rádio é bastante controlado, dado seus riscos associados à radiação. Contudo, embora tenha perdido espaço para isótopos mais seguros, como o 60Co, o rádio ainda pode ser utilizado para o tratamento de alguns tipos de câncer, como o de próstata quando avança para os ossos. Isso porque o elemento mimetiza o papel do cálcio, substituindo-o na constituição óssea. Dessa forma, o rádio emite partículas ɑ, cuja energia é suficiente para matar células cancerígenas.
O rádio também tem utilização na produção de tintas luminescentes e como fonte de nêutrons, principalmente por meio da liga rádio-berílio. Essa liga, utilizada para prospecção geofísica do petróleo, possui uma importância história, pois foi por meio dela que James Chadwick (Nobel de Física de 1935) descobriu o nêutron, em 1932. Foi também essa liga que Enrico Fermi (Nobel de Física de 1938) e seus colaboradores utilizaram para seus trabalhos de transmutação nuclear.
Precauções com o rádio
O rádio perde 1% de sua atividade a cada 25 anos, desintegrando-se em elementos mais leves. O chumbo é o último elemento da desintegração, sendo ele estável. O rádio, quando estocado, deve ser mantido em uma área ventilada, pois deve-se prevenir a formação de radônio. Exposições de diversas formas ao rádio podem causar câncer e outras doenças.
A carga máxima de rádio (226Ra) permitida no corpo humano é de 7400 becquerel, correspondente a 7400 desintegrações por segundo. Contudo, como apontado, 1,0 grama de rádio é capaz de produzir 3,7 x 1010 desintegrações por segundo, o que indica que é um elemento altamente periculoso.
Leia mais: Diferença entre contaminação radioativa e irradiação
História do rádio
A história do rádio está ligada a uma das maiores cientistas da história da humanidade: Marie Curie. Com seu marido, Pierre Curie, ela percebeu que dois minérios de urânio (a pechblenda e a calcolita) eram mais radioativos que o próprio urânio puro. Por isso, o casal começou a suspeitar que deveria haver mais um elemento na composição deles, ainda mais radioativo.
Com a ajuda de Gustave Bémont, os Curie apresentaram evidências de um novo elemento, muito semelhante ao bário. Ele foi chamado de rádio (palavra de origem latina que significa “raio”), justamente por ser mais radioativo do que qualquer elemento conhecido até então.
A partir de 1899, Marie e Pierre Curie se empenharam em isolar o rádio de uma tonelada de resíduos de pechblenda das minas de urânio de Joachimsthal, na Boêmia. Somente três anos depois, o casal conseguiu isolar o cloreto de rádio, em um árduo e paciente trabalho químico. A radioatividade do cristal de cloreto de rádio obtido era cerca de 2000 vezes maior que do urânio, além de brilhar no escuro.
Infelizmente, em 1906, Pierre Curie faleceu aos 47 anos em um acidente com uma carroça, fazendo com que Marie tivesse que prosseguir sem ele nas suas empreitadas científicas. Em 1910, junto a André-Louis Debierne, ela conseguiu isolar, por meio da eletrólise, uma amostra de rádio metálico.
Pierre e Marie Curie receberam o prêmio Nobel de Física em 1903, junto de Henri Becquerel, pela descoberta da radioatividade. Já em 1911, Marie Curie recebeu seu segundo prêmio Nobel, dessa vez de Química, por conta da descoberta dos elementos rádio e polônio. Marie Curie é a única pessoa a ter dois prêmios Nobel em áreas científicas diferentes até então.
Em 1934, ela faleceu de leucemia aos 66 anos, provavelmente por conta de uma longa vida dedicada aos estudos da radioatividade.

Um fato inusitado acerca do rádio é que sua descoberta trouxe um verdadeiro frenesi à sociedade. Em 1908, Frederick Soddy afirmou que a energia produzida pela desintegração do rádio era infinitamente mais alta se comparada a outras formas convencionais de produção de energia. Assim, empreendedores começaram a investir no elemento, fazendo-o se tornar uma commoditie do século XX.
O rádio começou a ser colocado em diversos produtos de saúde e cosméticos, como um verdadeiro elixir da beleza. Cafés, águas, cervejas, chocolates, pastas de dente, cremes faciais e supositórios eram exemplos de produtos que receberam rádio em sua composição. Foi utilizado para o tratamento de impotência sexual masculina e até introduzido na alimentação de galinhas, a fim de se obter ovos autoincubadores. O preço do rádio chegou a estrondosos 100 mil dólares a grama em 1921, impedindo a própria Marie Curie de obtê-lo para seus estudos.
O rádio também foi utilizado em tintas para relógios, fazendo com que seus ponteiros brilhassem na escuridão da noite. Para que os pincéis conseguissem ser finos o suficiente a fim de que os ponteiros fossem pintados, as mulheres que fabricavam esses relógios utilizavam seus lábios, ingerindo, continuamente, quantidades de rádio.
Não demorou para que surgissem problemas nelas: anemia severa, perda de dentes, câncer nos ossos e, até mesmo, morte. Por mais que reclamassem, por muito tempo as trabalhadoras (conhecidas como Garotas do Rádio) foram desacreditadas. Em 1927, elas processaram os fabricantes, o que, por mais que eles tentassem resolver de forma discreta, culminou com a queda de popularidade do rádio. De fato, à época, cientistas já alertavam para o uso indiscriminado do elemento.
Exercícios sobre rádio
Questão 1 (FGV SP)
O isótopo de massa 226 do elemento químico rádio (![]() ) é produzido naturalmente a partir do decaimento radioativo do
) é produzido naturalmente a partir do decaimento radioativo do ![]() . Os números de partículas alfa e beta emitidas para a obtenção de um átomo de
. Os números de partículas alfa e beta emitidas para a obtenção de um átomo de ![]() a partir do
a partir do ![]() são, respectivamente,
são, respectivamente,
(A) 2 e 3.
(B) 3 e 1.
(C) 3 e 2.
(D) 3 e 3.
(E) 4 e 1.
Resposta: letra C
A reação de desintegração do 238U pode ser dada como:
![]()
O número de partículas alfa (x) e o número de partículas beta (y) podem ser calculados pelo seguinte sistema:
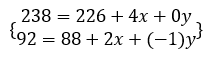
Isso porque o processo de desintegração deve ocorrer com conservação de massa (valores acima do símbolo do elemento) e de carga (valores abaixo do símbolo do elemento).
Fazendo-se os cálculos da primeira linha do sistema, temos:
238 – 226 = 4x
12 = 4x
x = 3 → 3 partículas alfa
Substituindo o valor de x na segunda linha do sistema, temos:
92 = 88 + 2(3) + (-1)y
92 – 88 – 6 = -y
-2 = -y
y = 2 → 2 partículas beta
Assim, o gabarito é o da letra C.
Questão 2 (Uerj)
Em um experimento pioneiro, a cientista Marie Curie isolou a forma metálica do elemento químico rádio por meio da eletrólise ígnea com eletrodos inertes do cloreto de rádio.
Nomeie o tipo de ligação interatômica presente no cloreto de rádio e escreva a equação química que representa a eletrólise desse elemento.
Resposta:
O cloreto de rádio possui a fórmula RaCl2. Por se tratar de um metal e um ametal, podemos inferir que a ligação será do tipo iônica, assim como os demais cloretos do grupo dos metais alcalinoterrosos. A diferença de eletronegatividade entre cloro (3,0) e rádio (aprox. 0,9) também supera o valor de 1,7, indicando que se trata de um composto iônico.
A eletrólise ígnea (ocorre sem água) serviu para obter-se o rádio em sua forma metálica (Ra0). Assim, a equação da eletrólise é a que se segue:
RaCl2 (l) → Ra (s) + Cl2 (g)
Por Stéfano Araújo Novais
Professor de Química

