Ionização é o fenômeno químico em que uma substância ácida (cuja fórmula geral é HX), quando dissolvida em água, origina dois íons: um cátion hidrônio (H3O+ ou H+) e um ânion qualquer (X-). O fenômeno é representado a partir de uma equação. Veja:
HX + H2O → H3O+ + X-
Durante uma ionização, apenas os hidrogênios ionizáveis do ácido transformam-se em cátions hidrônio, fator que depende ainda da capacidade de ionização que esse ácido apresenta, isto é, do grau de ionização (α). Dessa forma, nem todo hidrogênio forma hidrônio, a não ser que o ácido apresente um grau de ionização igual a 100%.
Porém, quando estamos montando uma equação de ionização, não levamos em consideração o grau de ionização do ácido, mas, sim, a quantidade de hidrogênios ionizáveis que ele apresenta.
Via de regra, consideramos hidrogênio ionizável todo hidrogênio presente em um hidrácido. No caso dos oxiácidos, são ionizáveis apenas os hidrogênios ligados a átomos de carbono, como podemos observar na fórmula estrutural representada abaixo:
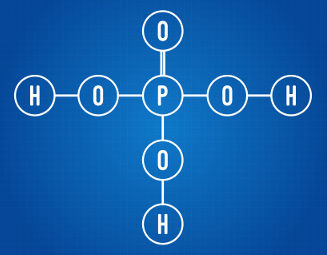
O ácido fosfórico apresenta três hidrogênios ionizáveis
Analisando a fórmula estrutural acima, podemos perceber que o ácido em questão possui três átomos de hidrogênios ligados a átomos de oxigênio. Sendo assim, ele apresenta um total de três hidrogênios ionizáveis.
Veja alguns exemplos de montagem de equação de ionização de alguns ácidos:
Exemplo 1: Ácido bromídrico (HBr)
HBr + H2O → H3O+ + Br-
O ácido bromídrico é um hidrácido com apenas um hidrogênio na sua composição. Como todo hidrogênio de um hidrácido pode ser ionizado, ele forma, ao se dissolver na água, apenas um mol de cátion hidrônio e o ânion brometo (Br-).
Exemplo 2: Ácido sulfídrico (H2S)
H2S + 2 H2O → 2 H+ + S-2
O ácido sulfídrico é um hidrácido com dois hidrogênios na sua composição. Como todo hidrogênio de um hidrácido pode ser ionizado, ele forma, ao se dissolver na água, dois mols de cátions hidrônios e o ânion sulfeto (S-2). Para isso, foram utilizados dois mols de água.
Exemplo 3: Ácido mangânico (H2MnO4)
H2MnO4 + 2 H2O → 2 H3O+ + MnO4-2
O ácido mangânico é um oxiácido com dois hidrogênios na sua composição. Como nos oxiácidos só é ionizável o hidrogênio ligado a um oxigênio – no caso do ácido mangânico, os dois hidrogênios são –, ele formará, ao se dissolver na água, dois mols de cátions hidrônios e o ânion manganato (MnO4-2). Para isso, foram utilizados dois mols de água.
Exemplo 4: Ácido fosforoso (H3PO3)
H3PO3 + 2 H2O → 2 H3O+ + HPO3-2
O ácido fosforoso é um oxiácido com três hidrogênios na sua composição. Como nos oxiácidos só é ionizável o hidrogênio ligado a um oxigênio – no caso do ácido fosforoso, os dois hidrogênios são –, ele formará, ao se dissolver na água, dois mols de cátions hidrônios e o ânion fosfito (HPO3-2). Para isso, foram utilizados dois mols de água.
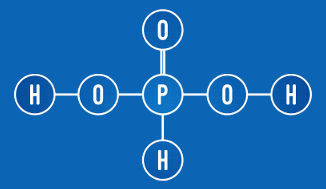
O ácido fosforoso apresenta dois hidrogênios ionizáveis (grupo OH)
Exemplo 5: Ácido bórico (H3BO3)
H3BO3 + 3 H2O → 3 H+ + BO3-3
O ácido bórico é um oxiácido com três hidrogênios na sua composição. Como nos oxiácidos só é ionizável o hidrogênio ligado a um oxigênio – no caso do ácido bórico, os três hidrogênios são –, ele formará, ao se dissolver na água, três mols de cátions hidrônios e o ânion borato (BO3-3). Para isso, foram utilizados três mols de água.
Exemplo 6: Ácido pirofosfórico (H4P2O7)
H4P2O7 + 4 H2O → 4 H3O+ + P2O7-4
O ácido pirofosfórico é um oxiácido com quatro hidrogênios na sua composição. Como nos oxiácidos só é ionizável o hidrogênio ligado a um oxigênio – no caso do ácido bórico, os quatro hidrogênios são –, ele formará, ao se dissolver na água, quatro mols de cátions hidrônios e o ânion pirofosfato (P2O7-4). Para isso, foram utilizados quatro mols de água.
Por Me. Diogo Lopes Dias