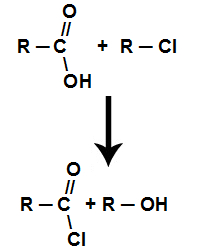
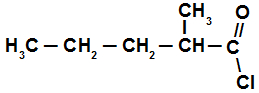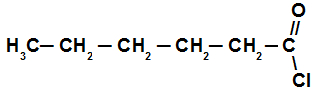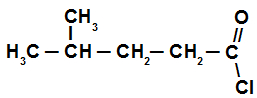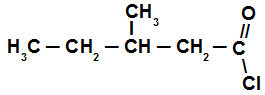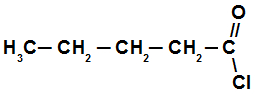Denomina-se de cloreto de ácido toda função orgânica derivada da reação entre um ácido carboxílico e um haleto orgânico. A seguir temos a equação que demonstra a formação de um cloreto de ácido e um álcool:
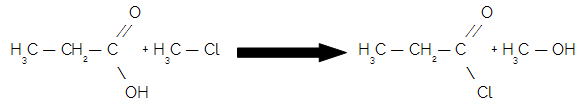
Equação da formação de um cloreto de ácido a partir de um ácido carboxílico e haleto orgânico
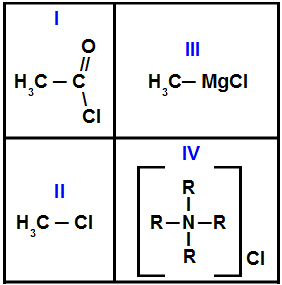
Podemos observar que o grupo funcional de um cloreto de ácido apresenta uma carbonila que possui um átomo de cloro. Na carbonila, temos ainda a presença do radical orgânico. Assim, podemos resumir o grupo funcional de um cloreto de ácido como:
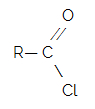
Os cloretos de ácidos são muito utilizados nas chamadas sínteses orgânicas, ou seja, participam da formação de outros compostos orgânicos, como ácidos carboxílicos, ésteres e éteres. Além disso, eles apresentam como principais características:
-
Apresentam uma densidade maior do que a da água;
-
São compostos polares em razão da presença da carbonila e do átomo de cloro na extremidade da cadeia;
-
Não possuem uma boa solubilidade em água, sendo mais solúveis em solventes orgânicos;
Não pare agora... Tem mais depois da publicidade ;) -
Em sua maioria, apresentam-se no estado sólido em temperatura ambiente. Todavia, os cloretos de ácido com menor massa molar encontram-se geralmente no estado líquido.
Apresentam pontos de fusão e ebulição mais baixos do que os ácidos carboxílicos, por exemplo. -
São compostos orgânicos extremamente reativos.
A nomenclatura IUPAC para os cloretos de ácido baseia-se na seguinte regra:
Cloreto + de + prefixo + infixo + oíla
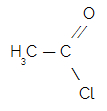
Exemplo: Cloreto de etanoíla – Estrutura com cinco átomos de carbono (Et), apenas ligações simples (an) e, como é um cloreto de ácido, termina em oíla.
Exemplo: Estrutura com cinco átomos de carbono (Pent), apenas ligações simples (an) e, como é um haleto de ácido, termina em oíla. Logo, temos o cloreto de pentanoíla.
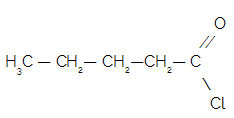
Exemplo: Estrutura com três átomos de carbono (Prop), uma ligação dupla (en) e, como é um cloreto de ácido, termina em oíla. Logo, temos o cloreto de propenoíla.
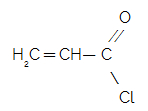
Por Me. Diogo Lopes Dias