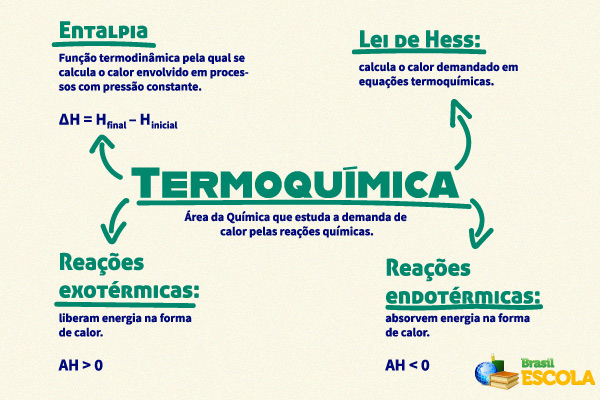
A termoquímica é um ramo da termodinâmica dentro da Química e estuda a demanda de calor pelas reações químicas. A quantidade de energia transferida na forma de calor em uma reação química pode ser medida por meio de uma grandeza termodinâmica, conhecida como entalpia, comumente representada pela letra H. Uma reação termoquímica pode ser endotérmica, se absorver energia na forma de calor, ou exotérmica, se liberar energia na forma de calor.
A termoquímica é de grande importância para a sociedade, pois pode ser utilizada para mensurar a capacidade energética de combustíveis, bem como o conteúdo energético dos alimentos. Uma das formas de cálculo de calor demandado em reações químicas se dá pela lei de Hess, que se aproveita de a entalpia ser uma função de estado.
Leia também: O que a Físico-Química estuda?
Tópicos deste artigo
- 1 - Resumo sobre termoquímica
- 2 - O que é termoquímica?
- 3 - Entalpia
- 4 - Tipos de reações termoquímicas
- 5 - Equação termoquímica
- 6 - Lei de Hess
- 7 - Aplicações da termoquímica
- 8 - Exercícios resolvidos sobre termoquímica
Resumo sobre termoquímica
- A termoquímica é a área da Química que estuda a demanda de calor pelas reações químicas.
- A quantidade de calor transferida em uma reação química pode ser mensurada pela entalpia, uma ferramenta termodinâmica.
- As reações termoquímicas podem ser exotérmicas, quando liberam energia na forma de calor, ou endotérmicas, quando absorvem energia na forma de calor.
- As equações termoquímicas são formas de se representar reações termoquímicas.
- A lei de Hess é uma importante metodologia para calcular o calor demandado em equações termoquímicas, pois aproveita-se de que a variação de entalpia é uma função de estado.
- A termoquímica é de grande importância, pois é utilizada para mensurar a quantidade de calor envolvida em processos químicos, tal qual a combustão de combustíveis e o conteúdo energético dos alimentos.
O que é termoquímica?
As reações químicas demandam energia, ou seja, uma reação química pode produzir energia da mesma forma que ela pode necessitar de energia para ocorrer. A termoquímica, assim sendo, estuda a demanda de calor das reações químicas.
Vale lembrar que o calor é uma forma de transferência de energia que decorre das diferenças de temperatura entre o sistema de análise e a vizinhança, sendo, na maioria das vezes, representado pela letra Q.
Dessa forma, um sistema químico pode realizar uma reação em que pode ocorrer transferência de energia na forma de calor para o meio externo; assim como pode absorver a energia transferida na forma de calor para desencadear um processo químico.
Entalpia
No século XIX, a queda da teoria do calórico, que tratava o calor como uma substância material, fez com que os químicos procurassem novas formas de mensurar o calor demandado em reações químicas. Nesse contexto surgiu, com o desenvolvimento da termodinâmica e pelas mãos de Josiah Willard Gibbs, a correlação entre calor e entalpia, representada pela letra H.
A entalpia é uma grandeza termodinâmica associada à energia interna de um corpo que, em processos isobáricos (pressão constante), apresenta uma variação numericamente igual à quantidade calor transferida entre sistema e vizinhança. Assim, podemos escrever que:
ΔH = Q, em pressão constante
Sempre é importante lembrar que entalpia não é sinônimo de calor ou de conteúdo de calor ou de qualquer coisa do gênero. Deve-se pensar na entalpia como uma ferramenta importante para o cálculo do calor envolvido em processos químicos, uma vez que boa parte das reações ocorre sem variação de pressão.
→ Videoaula sobre entalpia
Tipos de reações termoquímicas
Reações químicas ocorrem com transferência de energia. Se a energia transferida ocorrer na forma de calor, podemos dizer que uma reação química transfere energia para a vizinhaça, ou que absorve a energia da vizinhança, na forma de calor, para ocorrer.
Assim, são conhecidas como reações exotérmicas as reações químicas que transferem energia, na forma de calor, para a vizinhança. Em termos mais simples, tais reações liberam energia na forma de calor.
Uma consequência importante das reações exotérmicas e que pode ser observada é, na maioria das vezes, o aumento da temperatura das fronteiras do sistema (como as paredes do frasco em que ocorre a reação) ou do meio externo. Um exemplo de reação exotérmica é a combustão.

Já as reações que absorvem energia na forma de calor do meio externo para que possam ser realizadas são conhecidas como endotérmicas. É possível perceber, na maioria das vezes, que uma reação é endotérmica quando a temperatura das fronteiras do sistema ou do meio externo diminui. A dissolução do cloreto de amônio em meio aquoso, por exemplo, é uma reação endotérmica.
Leia também: Diferenças entre processos endotérmicos e exotérmicos
Equação termoquímica
Quando queremos representar uma reação termoquímica, devemos utilizar as equações termoquímicas. A diferença em relação às equações químicas tradicionais é que, nas equações termoquímicas, devemos apresentar a variação de entalpia ou a quantidade de energia transferida na forma de calor, de modo a identificar se o processo é exotérmico ou endotérmico. Tanto a quantidade de calor quanto a entalpia utilizam as unidades de energia caloria (em geral, quilocalorias, kcal) ou Joule (em geral, quilojoules, kJ).
A variação de entalpia, ΔH, sendo numericamente igual ao calor transferido, pode ser tanto positiva quanto negativa. Sendo uma variação de entalpia uma função de estado, entende-se que ela só depende do seu ponto inicial e do seu ponto final; logo, é possível dizer que:
ΔH = Hfinal – Hinicial
Como os reagentes estão presentes no estágio inicial de uma reação química e os produtos estão no estágio final de uma reação química, essa fórmula pode ser representada como:
ΔH = Hprodutos – Hreagentes
Se ΔH > 0, entende-se que houve transferência de calor para a reação química, ou seja, ocorreu absorção de calor para transformar quimicamente os reagentes em produtos; assim sendo, o processo é endotérmico.
Do contrário, caso ΔH < 0, entende-se que houve transferência de calor da reação química para a vizinhança, ou seja, a energia química produzida na conversão dos reagentes em produtos foi liberada na forma de calor; assim sendo, o processo é exotérmico.
Um processo endotérmico pode ser equacionado da seguinte forma:
CO2 (g) + 2 H2O (l) + 890 kJ → CH4 (g) + 2 O2 (g) ou:
CO2 (g) + 2 H2O (l) → CH4 (g) + 2 O2 (g) ΔH = +890 kJ
Já um processo exotérmico pode ser equacionado da seguinte forma:
C6H12O6 (s) + 6 O2 (g) → 6 CO2 (g) + 6 H2O (l) + 2808 kJ ou:
C6H12O6 (s) + 6 O2 (g) → 6 CO2 (g) + 6 H2O (l) ΔH = −2808 kJ
Lei de Hess
A entalpia é uma função de estado, assim, o valor de ΔH não depende do caminho tomado, ou seja, não depende da rota da reação química, levando-se em conta apenas os estados inicial ou final da reação.
Então, por exemplo, caso se queira saber a variação de entalpia em um processo de sublimação (passagem de sólido para gás diretamente), pode-se considerar que tal variação é a soma da variação de entalpia do processo de fusão (sólido para líquido) com a variação de entalpia do processo de vaporização (líquido para gás). Isso porque os estados inicial e final dessa rota são exatamente os mesmos do processo de sublimação.
ΔHsublimação = ΔHfusão + ΔHvaporização
Assim, não importa o caminho tomado, mas sim que, no início, a matéria estava sólida e, no fim, ela estava gasosa, tal qual um processo de sublimação.
Em reações químicas, esse procedimento também se aplica. Nesse caso, conhecemos tal regra como lei de Hess. Assim, a lei de Hess nos diz que a variação de entalpia total de uma reação é a soma das variações de entalpia das reações que agem como etapas reacionais. Por exemplo, de forma simples:
Etapa I: A + B → AB ΔHI
Etapa II: AB + C → AC + B ΔHII
Se juntarmos as etapas I e II, teremos a seguinte reação:
A + B + AB + C → AB + AC + B
Simplificando as substâncias que são idênticas, a reação é, então:
A + C → AC
E o ΔH dessa reação será justamente a soma de ΔHI com ΔHII.
O grande trunfo da lei de Hess é que é possível utilizar reações hipotéticas, ou seja, que não são reprodutíveis em laboratório. Outro ponto importante é a previsão da variação de entalpia de uma reação, ainda não conhecida, com base nas variações de entalpias conhecidas de outras reações. Na metodologia da lei de Hess, é possível, ainda, tratar equações termoquímicas como matemáticas, fazendo-se ajustes para se chegar à reação de interesse.
Por exemplo, suponha que haja o interesse em determinar a variação de entalpia da reação 3 C (graf.) + 4 H2 (g) → C3H8 (g). Para tal, são fornecidas três reações que poderão ser consideradas etapas de formação da reação de interesse:
I) C3H8 (g) + 5 O2 (g) → 3 CO2 (g) + 4 H2O (l) ΔH = −2220 kJ
II) C (graf.) + O2 (g) → CO2 (g) ΔH = −394 kJ
III) H2 (g) + ½ O2 (g) → H2O (l) ΔH = −286 kJ
Pela lei de Hess, é possível mobilizar as reações I, II e III como equações matemáticas, de modo que, quando somadas semelhantemente a um sistema, chega-se à reação de interesse. Por exemplo, na reação de interesse o C3H8 (g) é um produto.
Entre as reações fornecidas, a única que contém tal substância é a equação termoquímica I. Contudo, nela, o C3H8 é um reagente. Por isso, pode-se inverter o sentido da equação I. Como consequência, o ΔH também será invertido (se era exotérmico, agora será endotérmico, já que é uma função de estado):
I) 3 CO2 (g) + 4 H2O (l) → C3H8 (g) + 5 O2 (g) ΔH = +2220 kJ
Também se percebe que há a necessidade de 3 mols de C (graf.) na reação de interesse como um reagente. A equação II até fornece C (graf.) como um reagente, porém apenas 1 mol. Dessa forma, pode-se multiplicar os coeficientes estequiométricos da reação II por 3, e, nesse caso, o ΔH também deverá ser multiplicado por 3.
II) 3 C (graf.) + 3 O2 (g) → 3 CO2 (g) ΔH = −1182 kJ
Por fim, percebe-se que a reação de interesse exige 4 mols de H2 (g) como reagente. A única equação que fornece essa substância é a III. Contudo, assim como anteriormente, a quantidade não está correta. Dessa forma, deve-se multiplicar os coeficientes estequiométricos por 4. O ΔH, como no último caso, também será multiplicado por 4.
III) 4 H2 (g) + 2 O2 (g) → 4 H2O (l) ΔH = −1144 kJ
Para se ter certeza de que tudo foi feito corretamente, deve-se somar as equações modificadas I, II e III tal qual num sistema matemático. Assim, substâncias que apresentem o mesmo coeficiente estequiométrico, mas que estejam em lados opostos da seta, deverão ser simplificadas. Se estiverem do mesmo lado, deverão ser somadas. Caso a resposta seja idêntica à equação de interesse, então o procedimento foi feito corretamente, e, para finalizar, basta somar-se os valores de entalpia.
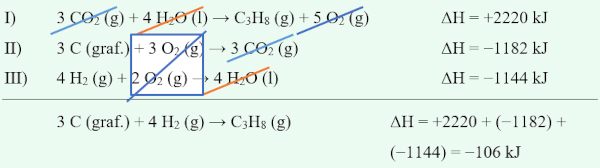
Percebe-se que o O2 (g) total nas equações II e III, por meio da soma (estavam do mesmo lado da seta), resultou em 5 mols de O2 (g), simplificado com os 5 mols de O2 (g) da equação I.
Assim, a reação 3 C (graf.) + 4 H2 (g) → C3H8 (g) tem um ΔH = −106 kJ.
Aplicações da termoquímica
Determinar as variações de entalpia de reações é de grande interesse para a Química. Graças à termoquímica e a seus cálculos, é possível determinar a quantidade de energia produzida por determinado combustível que sofrerá combustão na câmara de um motor ou em uma usina. Assim, é possível determinar qual combustível apresentará melhor ou pior rendimento energético dentro dos parâmetros estabelecidos.
Dentro de toda a demanda que a sociedade apresenta acerca de efeitos causados pelas mudanças climáticas, conhecer os combustíveis e suas capacidades energéticas é muito importante.
Da mesma forma, a energia contida em alimentos também pode ser determinada por meio de estudos da termoquímica. Os valores energéticos encontrados em tabelas nutricionais são calculados com base na combustão dos alimentos em calorímetros específicos, conhecidos como calorímetros bomba.
No mais, nenhuma reação química ocorre sem energia, sendo que comumente essa energia é transferida na forma de calor.
Exercícios resolvidos sobre termoquímica
Questão 1
(UFRR 3ª Etapa/2023) Sabendo que a entalpia de dissolução do nitrato de amônio é de 21,1 kJ mol−1,
(NH4)NO3 (s) → NH4+ (aq) + NO3− (aq) ∆H = +21,1 kJ mol−1
É CORRETO afirmar que:
(A) O processo é exotérmico.
(B) Calor é liberado para o ambiente durante o processo de dissolução.
(C) O processo é endotérmico.
(D) O sal não é solúvel.
(E) Nenhuma das anteriores.
Resposta: Letra C
É possível perceber que o ∆H é um valor maior que zero (+21,1); assim sendo, caracteriza-se o processo como endotérmico.
Questão 2
(Unesp/2023-2) Analise os diagramas de entalpias de reações parciais, associadas com a reação de cal viva sólida, CaO (s), com água líquida, para a produção de cal hidratada sólida, Ca(OH), (s).
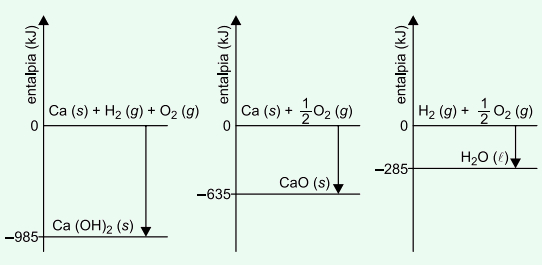
A variação de entalpia dessa reação de cal viva com água líquida, para produzir cal hidratada, é igual a
(A) −1905 kJ/mol.
(B) −65 kJ/mol.
(C) +95 kJ/mol.
(D) −1620 kJ/mol.
(E) +2890 kJ/mol.
Resposta: Letra B
A reação da cal viva com água líquida para produzir cal hidratada é:
CaO (s) + H2O (l) → Ca(OH)2 (s)
A variação de entalpia dessa reação pode ser obtida por meio das equações termoquímicas dadas pelos diagramas. Transferindo as informações dos diagramas, temos que:
Ca (s) + H2 (g) + O2 (g) → Ca(OH)2 (s) ∆H = −985 kJ
Ca (s) + ½ O2 (g) → CaO (s) ∆H = −635 kJ
H2 (g) + ½ O2 (g) → H2O (l) ∆H = −285 kJ
Utilizando a lei de Hess, modificamos as equações pensando na reação exigida pelo exercício:
Ca (s) + H2 (g) + O2 (g) → Ca(OH)2 (s) ∆H = −985 kJ
CaO (s) → Ca (s) + ½ O2 (g) ∆H = +635 kJ
H2O (l) → H2 (g) + ½ O2 (g) ∆H = +285 kJ
CaO (s) + H2O (l) → Ca(OH)2 (s)
O somatório das equações modificadas, simplificando-se as substâncias que são iguais e estão em lados opostos, originou a equação química exigida pelo exercício. Assim, a variação de entalpia é dada por:
∆H = −985 + 635 + 285
∆H = −65 kJ
Fontes
ATKINS, P.; DE PAULA, J.; KEELER, J. Physical Chemistry. 11. ed. Oxford: Oxford University Press, 2018.
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
CASTELLAN, G. Fundamentos de Físico-Química. 1. ed. Barueri: LTC Editora, 1986.
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
SILVA, José Luis de Paula Barros. Por que não estudar entalpia no Ensino Médio. Química Nova na Escola. v. 22. nov. 2005