A entalpia de formação, também denominada entalpia-padrão de formação, ou calor-padrão de formação, é o cálculo do calor liberado ou absorvido na formação de 1 mol de uma substância a partir de substâncias simples, no estado padrão.
É impossível calcular o valor absoluto das entalpias de cada substância, mas é possível calcular a variação da entalpia que ocorre na reação, por meio de um calorímetro.
É preciso lembrar que se convencionou adotar o valor da entalpia igual a zero para as substâncias simples no estado padrão. Dessa forma, se quisermos descobrir qual é a entalpia de formação de uma substância é só saber o valor da entalpia da reação de formação dela a partir de substâncias simples.
Por exemplo: queremos descobrir a entalpia de 18 gramas de água, que corresponde a 1 mol, pois sua massa molar é de 18 g /mol. Para tal, precisamos primeiro da reação de formação da água a partir de substâncias simples, conforme mostrado abaixo:
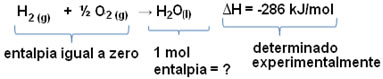
Observe que o valor da variação da entalpia que houve nessa reação foi determinado experimentalmente por meio de um calorímetro e é igual a -286 kJ/mol.
A fórmula que calcula essa variação de entalpia (ΔH) é:
ΔH = HProdutos – HReagentes
Assim, visto que já sabemos o valor de ΔH e que a entalpia dos reagentes é igual a zero (pois são substâncias simples no estado padrão), podemos, então, concluir que o valor da entalpia de 1 mol de água é igual à variação de entalpia da reação de formação, já que ela é o único produto dessa reação, conforme mostrado abaixo:
ΔH = HProdutos – HReagentes
-286 kJ/mol = HH2O – (HH2 + H1/2 O2)
-286 kJ/mol = HH2O – 0
HH2O = - 286 kJ/mol
Esse tipo de entalpia, conseguido a partir da entalpia das substâncias simples no estado padrão é, portanto, a entalpia padrão de formação (ΔH0).
Agora, existem muitas substâncias que não são formadas diretamente por uma única reação, como é o caso da água. Nesses casos, a entalpia de formação pode ser calculada a partir da variação de entalpia da reação.
Por exemplo, o NH4Cl é formado pela seguinte reação:
NH3 + HCl → NH4Cl ΔH = -176 kJ/mol
Observe que nenhum dos reagentes é uma substância simples, portanto, não podemos atribuir a eles a entalpia igual a zero. Precisamos saber as entalpias de formação de cada um dos reagentes, pois esses sim são formados por reações entre substâncias simples:
NH3 : ΔH = -46 kJ/mol
HCl : ΔH = -92,4 kJ/mol
Somando essas duas entalpias, obtemos o valor da entalpia dos reagentes e podemos descobrir a entalpia do NH4Cl:
HR = HNH3 + HHCl
HR = (-46 + (-92,4) kJ/mol)
HR = -138,4 kJ/mol
Substituindo na fórmula:
ΔH = HProdutos – HReagentes
-176 = HNH4Cl - ( -138,4)
HNH4Cl = - 176 - 138,4
HNH4Cl = -314,4 kJ/mol
Nesse caso, somamos diretamente os valores das entalpias de formação dos reagentes porque a proporção da reação era de apenas 1 mol. No entanto, se em outras reações a quantidade de mols for diferente, será necessário primeiro multiplicar a entalpia de formação do reagente pelo número de mols.
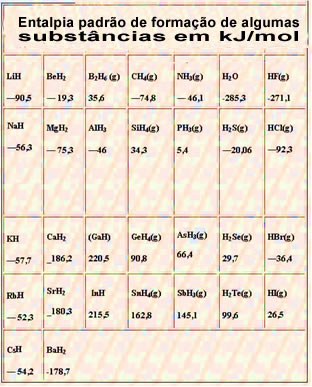
Abaixo segue uma tabela com a entalpia padrão de formação de algumas substâncias a 25 °C e 1 atm:
Por Jennifer Fogaça
Graduada em Química