A entalpia é uma função termodinâmica pela qual se calcula o calor envolvido em processos isobáricos, ou seja, que se mantêm com pressão constante. Seu desenvolvimento ocorreu logo após a queda da teoria do calórico, com o avanço da termodinâmica entre os anos de 1840 e 1850.
A entalpia, para a química, não possui muito significado se for trabalhada como um valor absoluto e isolado, mas tem quando se considera a variação de seu valor em um processo químico. Existem diversas formas de se calcular a variação de entalpia de um processo, sendo as principais por meio das energias de formação, ligação e também pela lei de Hess.
Leia também: O que é energia livre de Gibbs?
Tópicos deste artigo
- 1 - Resumo sobre entalpia
- 2 - Videoaula sobre entalpia
- 3 - O que é entalpia?
- 4 - Variação de entalpia
- 5 - Tipos de entalpia
- 6 - Exercícios resolvidos sobre entalpia
Resumo sobre entalpia
-
A entalpia é uma ferramenta termodinâmica para o cálculo do calor envolvido em processos que ocorrem à pressão constante.
-
Foi definida pelo físico americano Josiah W. Gibbs, no contexto da queda da teoria do calórico.
-
Em química, sempre utilizamos a variação de entalpia, representada como ΔH.
-
Reações químicas que absorvem calor são chamadas de endotérmicas e possuem ΔH > 0.
-
Reações químicas que liberam calor são chamadas de exotérmicas e possuem ΔH < 0.
Videoaula sobre entalpia
O que é entalpia?
A entalpia, representada sempre por H, foi inicialmente definida pelo físico americano Josiah Willard Gibbs, o qual a denominou como função calor à pressão constante, uma vez que, nas suas palavras:
“[…] a diminuição da função representa, em todos os casos em que a pressão não varia, o calor cedido pelo sistema.”
Do trabalho de Gibbs, então, podemos entender a entalpia como uma função termodinâmica cuja variação é numericamente igual à quantidade de calor trocado no sistema, à pressão constante. Isso quer dizer que, em processos isobáricos (como a maioria dos processos químicos), sabendo-se calcular a variação da função entalpia, pode-se então saber o valor do calor trocado entre sistema e vizinhança.

Tal correlação com o calor faz com que muitos estudantes pensem, erroneamente, que a entalpia é sinônimo de calor ou algo como conteúdo de energia, conteúdo de calor, calor liberado e calor absorvido, e similares.
A entalpia surgiu no contexto da derrocada da teoria do calórico, a qual tratava o calor como uma substância material imponderável que se transferia de corpos mais quentes para corpos mais frios. Assim, surgiu-se a necessidade de se ter uma nova ferramenta para o cálculo do calor. A solução, então, foi utilizar-se de grandezas que já tinham equações termodinâmicas definidas, como a entalpia.
Leia também: Como calcular a variação de entalpia de solução?
Variação de entalpia
Já que a entalpia é uma ferramenta utilizada para o cálculo do calor trocado em um processo químico, não faz sentido a sua utilização como um número absoluto, isolado, mas sim considerando sua variação, ou seja, na prática, só devemos avaliar quanto, numericamente, variou a entalpia durante o processo químico, uma vez que a termodinâmica nos garante que sua variação é numericamente igual ao calor liberado ou absorvido no processo.
A rigor, podemos definir a variação de entalpia como:
ΔH = Hfinal – Hinicial
Como em processos químicos, a etapa final pode ser considerada os produtos e a etapa inicial pode ser considerada os reagentes. Também é comum ver a definição da variação de entalpia como:
ΔH = Hprodutos – Hreagentes
Do ponto de vista prático e interpretativo, se a variação de entalpia for positiva (ΔH > 0), nós dizemos que a reação química é endotérmica, ou seja, há absorção de calor ao longo do processo. Já se a variação de entalpia for negativa (ΔH < 0), nós dizemos que a reação química é exotérmica, ou seja, há liberação de calor ao longo do processo.
A variação de entalpia, em muitos casos, é observada em gráficos, como mostram os exemplos a seguir.
Exemplo 1:
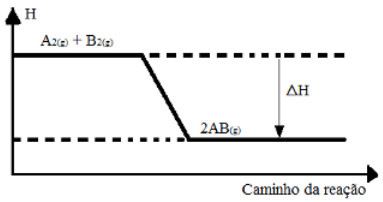
Gráfico de reação endotérmica
Nos gráficos de entalpia para reações endotérmicas, percebe-se que a quantidade de entalpia dos produtos é maior que a dos reagentes, indicando que a variação ao longo da reação é positiva. Assim, sendo ΔH > 0, podemos dizer que o processo químico ocorreu com absorção de calor.
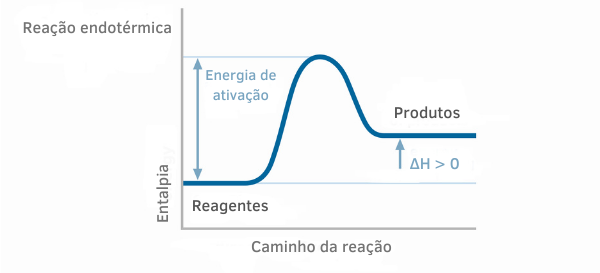
Exemplo 2:
Gráfico de reação exotérmica:
Nos gráficos de entalpia para reações exotérmicas, percebe-se que a quantidade de entalpia dos produtos é menor que a dos reagentes, indicando que a variação ao longo da reação é negativa. Assim, sendo ΔH < 0, podemos dizer que o processo químico ocorreu com liberação de calor.
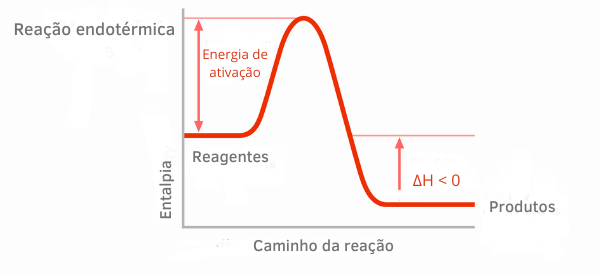
Leia mais sobre essas classificações das reações químicas no texto: Processos endotérmicos e exotérmicos.
Tipos de entalpia
-
Entalpia de formação
A entalpia de formação é calculada com base nas reações químicas de formação, que são reações em que um mol de substâncias compostas é formado de suas substâncias simples mais estáveis à temperatura ambiente e 1 atmosfera de pressão.
H2(g) + ½ O2 (g) → H2O (l) ΔH°f = -286 kJ/mol
A grande vantagem da entalpia de formação é que as substâncias simples mais estáveis à temperatura ambiente e 1 atmosfera de pressão possuem entalpia convencionadas como zero. Isso não quer dizer que de fato são zero, mas, para simplificação e melhor classificação, são tratadas assim.
Sendo ΔH = Hprodutos – Hreagentes, se considerarmos, então, que Hreagentes = 0, podemos afirmar que o valor de ΔH observado é apenas referente aos produtos, que, nesses casos, são sempre um mol da substância composta. Por isso, tabelamos esse valor como a variação de entalpia-padrão de formação da água, representada por ΔH°f.
Foi com essa metodologia que diversas substâncias tiveram suas variações de entalpia-padrão de formação tabeladas, como podemos ver a seguir.
|
Substância |
Entalpia de formação (ΔH°f) em kJ/mol |
|
CO2 (g) |
-393,4 |
|
CaO (s) |
-634,9 |
|
HI (g) |
+25,9 |
|
NO (g) |
+90,1 |
-
Entalpia de ligação
A entalpia de ligação serve para indicar a quantidade de energia envolvida na ruptura ou na formação de um mol de determinada ligação química.
Entende-se que, para se romper uma ligação química, faz-se necessário absorver calor, de modo que os átomos da ligação aumentem sua energia interna e, consequentemente, aumentem sua energia cinética. Com maior energia cinética, os átomos vibram com mais intensidade, causando o rompimento das ligações. Assim, todo rompimento de ligação é um processo endotérmico.
Do contrário, para se formar uma ligação química, os átomos perdem liberdade de movimento e precisam diminuir seu grau de movimentação, diminuindo sua energia cinética. A energia sobressalente é então liberada na forma de calor. Assim, toda formação de ligação é um processo exotérmico.
A tabela abaixo mostra valores das energias associadas a cada ligação química.
|
Ligação |
Energia de ligação (kJ/mol) |
|
C―H |
412,9 |
|
C―C |
347,8 |
|
O═O |
497,8 |
|
F―F |
154,6 |
|
N≡N |
943,8 |
Perceba que não existem sinais nos valores, estando eles em módulo. Isso porque o sinal deve ser atribuído por você, dependendo se a ligação for rompida ou formada.
-
Entalpia de combustão
A entalpia de combustão serve para indicar a quantidade de calor liberado na combustão de um mol de uma substância. Deve-se salientar que toda reação de combustão é exotérmica, pois toda queima libera calor.
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O ΔH°C = -889,5 kJ/mol
A tabela abaixo mostra valores de entalpia de combustão para algumas substâncias químicas.
|
Substância |
Entalpia de combustão (ΔH°C) em kJ/mol |
|
Etanol – C2H5OH (l) |
-1368 |
|
Benzeno – C6H6 (l) |
-3268 |
|
Octano – C8H18 (l) |
-5471 |
|
Glicose – C6H12O6 (s) |
-2808 |
-
Entalpia de mudança de estado físico
Toda mudança de estado físico envolve troca de calor. Sendo assim, a entalpia de mudança de estado físico serve para indicar a quantidade de calor envolvido nos processos de mudança de estado físico.
Por exemplo, temos a vaporização da água:
H2O (l) → H2O (g) ΔH = +44 kJ/mol
Já na fusão da água, temos:
H2O (s) → H2O (l) ΔH = +7,3 kJ/mol
Os valores de entalpia são simétricos para os processos inversos, o que quer dizer que, por exemplo, a variação de entalpia na liquefação da água é -44 kJ/mol, enquanto, na sua solidificação, ela é igual a -7,3 kJ/mol.
Leia também: O que é entropia?
Exercícios resolvidos sobre entalpia
Questão 1 - (UERJ 2018) A capacidade poluidora de um hidrocarboneto usado como combustível é determinada pela razão entre a energia liberada e a quantidade de CO2 formada em sua combustão completa. Quanto maior a razão, menor a capacidade poluidora. A tabela abaixo apresenta a entalpia-padrão de combustão de quatro hidrocarbonetos.

A partir da tabela, o hidrocarboneto com a menor capacidade poluidora é:
-
Octano
-
Hexano
-
Benzeno
-
Pentano
Resolução
Alternativa D
A questão indica que a capacidade poluidora é definida como sendo a razão (quociente) entre a energia liberada e a quantidade de CO2 formada em sua combustão completa. Quanto maior a razão, menor a capacidade poluidora, ou seja, mais energia é liberada por mol de CO2 gerado.
As reações de combustão completas dos hidrocarbonetos citados são:
Octano: C8H18 + 25/2 O2 → 8 CO2 + 9 H2O Razão: 5440/8 = 680
Hexano: C6H14 + 19/2 O2 → 6 CO2 + 7 H2O Razão: 4140/6 = 690
Benzeno: C6H6 + 15/2 O2 → 6 CO2 + 3 H2O Razão: 3270/6 = 545
Pentano: C5H12 + 8 O2 → 5 CO2 + 6 H2O Razão: 3510/5 = 702
Dessa forma, podemos concluir que o pentano é o hidrocarboneto de menor capacidade poluidora.
Questão 2 - (Enem 2015) O aproveitamento de resíduos florestais vem se tornando cada dia mais atrativo, pois eles são uma fonte renovável de energia. A figura representa a queima de um bio-óleo extraído do resíduo de madeira, sendo ΔH1 a variação de entalpia devido à queima de 1 g desse bio-óleo, resultando em gás carbônico e água líquida, e ΔH2 a variação de entalpia envolvida na conversão de 1 g de água no estado gasoso para o estado líquido.
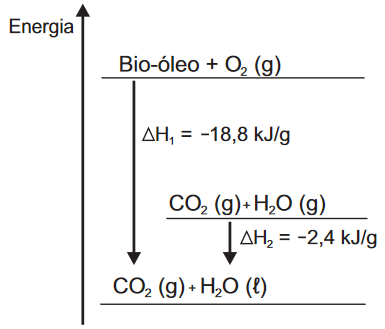
A variação de entalpia, em kJ, para a queima de 5 g desse bio-óleo, resultando em CO2 (gasoso) e H2O (gasoso), é:
A) -106
B) -94
C) -82
D) -21,2
E) -16,4
Resolução
Alternativa C
Pelo gráfico apresentado, temos ΔH1 como sendo a variação de entalpia da queima do bio-óleo, produzindo CO2 (g) e H2O (l) e ΔH2 como sendo a variação de entalpia da liquefação da água, uma vez que o CO2 se mantém gasoso e apenas o estado físico da água se altera (de gasoso para líquido).
O exercício pede a variação de entalpia da queima de 5 g do bio-óleo, resultando em CO2 (gasoso) e H2O (gasoso). Pelo diagrama, essa variação de entalpia pode ser definida como ΔH = ΔH1 – ΔH2. Assim, o valor de ΔH será igual a -16,4 kJ/g. Essa variação, como podemos perceber na unidade, é para CADA grama do bio-óleo. Para 5 gramas, devemos fazer a proporção:
1 g do bio-óleo ------------- -16,4 kJ
5 g do bio-óleo ------------- x
1 . x = 5 . (-16,4)
x = -82 kJ
Podemos, então, marcar a alternativa C.
Por Stéfano Araújo Novais
Professor de Química