Reações endotérmicas e exotérmicas são processos que envolvem troca de energia com o ambiente, um aspecto essencial para entender o comportamento de diversas reações químicas, tanto na natureza quanto em aplicações industriais.
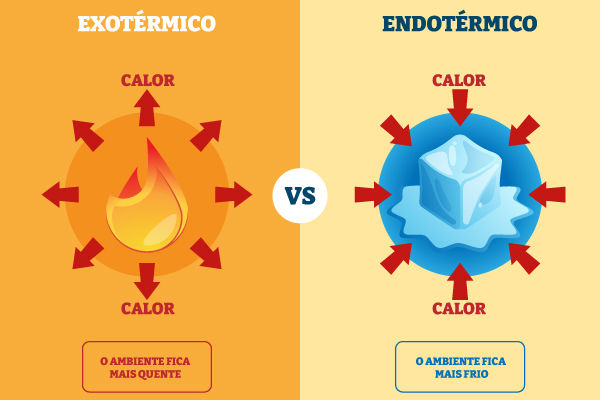
Essas reações são classificadas de acordo com a direção do fluxo de energia: enquanto uma reação exotérmica libera energia para o ambiente, uma reação endotérmica absorve energia. A chave para entender essa troca de energia é o conceito de entalpia (H), que mede a quantidade de energia contida nas ligações químicas das substâncias envolvidas.
Leia também: Mudanças no estado físico da matéria — quais são os tipos, como ocorrem
Tópicos deste artigo
- 1 - Resumo sobre reações endotérmicas e exotérmicas
- 2 - Videoaula sobre reações endotérmicas e exotérmicas
- 3 - O que são reações endotérmicas e exotérmicas?
- 4 - Diferenças entre reação endotérmica e reação exotérmica
- 5 - Como identificar reações endotérmicas e exotérmicas?
- 6 - Cálculo de reações endotérmicas e exotérmicas
- 7 - O que é entalpia?
- 8 - Reações endotérmicas e exotérmicas no dia a dia
- 9 - Exercícios resolvidos sobre reações endotérmicas e exotérmicas
Resumo sobre reações endotérmicas e exotérmicas
- Reações endotérmicas e exotérmicas são processos que envolvem troca de energia com o ambiente.
- A reação endotérmica ocorre com absorção de energia e apresenta ΔH > 0. Por outro lado, a reação exotérmica, ocorre com liberação de energia e apresenta ΔH < 0.
- Reações endotérmicas e exotérmicas podem ser identificadas por meio de gráficos, diagramas e equações termoquímicas.
- A variação de entalpia pode ser calculada por meio da Lei de Hess, da entalpia de formação e da energia de ligação.
- Entalpia é uma grandeza termodinâmica que representa a quantidade total de energia de um sistema em função de sua pressão e volume.
- Reações endotérmicas estão relacionadas com a sensação de frio, pois absorvem calor das vizinhanças; e reações exotérmicas estão relacionadas com a sensação de quente, pois liberam calor para as vizinhanças.
Videoaula sobre reações endotérmicas e exotérmicas
O que são reações endotérmicas e exotérmicas?
As reações endotérmicas são processos nos quais a energia é absorvida do ambiente, resultando em uma diminuição da temperatura ao redor. Esse tipo de reação exige um suprimento contínuo de energia para que ocorra.
Um exemplo notável de reação endotérmica é a fotossíntese, em que plantas capturam a luz solar e absorvem dióxido de carbono e água para produzir glicose e oxigênio, armazenando a energia solar em suas ligações químicas. Outro exemplo é o uso de gelo instantâneo, que utiliza uma reação endotérmica para absorver calor rapidamente e fornecer uma sensação de frio, geralmente usada para lesões esportivas.
As reações exotérmicas, por outro lado, são processos que liberam energia para o ambiente, frequentemente na forma de calor. A combustão de materiais orgânicos, como madeira e gasolina, é um exemplo clássico. Durante a combustão, ocorre a quebra e a formação de novas ligações químicas, resultando num excesso de energia, que é liberada, aquecendo o ambiente ao redor.
A queima de carvão e de gás natural para gerar eletricidade também é um exemplo de processo industrial exotérmico, pois ambos liberam grandes quantidades de calor, o que gera vapor para movimentar turbinas.
Essas reações químicas refletem fenômenos fundamentais que envolvem a troca de energia, e ambos os tipos de reação desempenham papéis importantes em processos biológicos e industriais, influenciando desde o metabolismo dos organismos até a eficiência de processos de manufatura.
Veja também: Qual é a diferença entre calor e temperatura?
Diferenças entre reação endotérmica e reação exotérmica
A diferença entre reações endotérmicas e exotérmicas está diretamente relacionada à variação de entalpia (ΔH) e à direção do fluxo de energia.
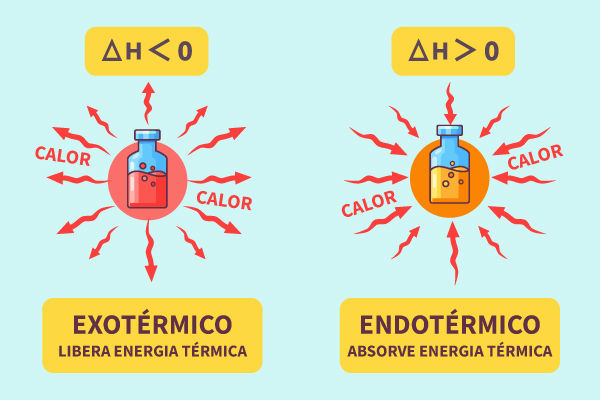
Em uma reação endotérmica, a variação de entalpia é positiva (ΔH > 0), o que indica que os reagentes absorvem energia para se converterem em produtos. Já em uma reação exotérmica, a variação de entalpia é negativa (ΔH < 0), o que indica que os produtos têm menos energia do que os reagentes, resultando na liberação de calor para o ambiente.
Essas diferenças são centrais para entender a dinâmica das reações químicas e como a energia se distribui e transforma durante os processos de quebra e formação de ligações químicas.
Como identificar reações endotérmicas e exotérmicas?
A identificação de reações endotérmicas e exotérmicas pode ser feita de várias formas, incluindo representações gráficas e equações termoquímicas. Cada uma dessas representações ajuda a visualizar como a energia é transformada e distribuída em diferentes reações químicas.
Entender esses gráficos e equações permite determinar se uma reação é endotérmica (absorve energia) ou exotérmica (libera energia) e compreender a relação com a variação de entalpia (ΔH), um valor que indica a quantidade de calor trocada entre o sistema e o ambiente.
→ Gráfico de reação endotérmica: variação de entalpia positiva (ΔH > 0)
Em um processo endotérmico, o sistema precisa absorver energia do ambiente para que a reação ocorra. Quando representamos essa reação em um gráfico de energia, percebemos que o nível de energia dos produtos é maior que o nível de energia dos reagentes, como mostra o gráfico a seguir.
Em um processo endotérmico, o sistema precisa absorver energia do ambiente para que a reação ocorra. Quando representamos essa reação em um gráfico de energia, percebemos que o nível de energia dos produtos é maior que o nível de energia dos reagentes, como mostra o gráfico a seguir.
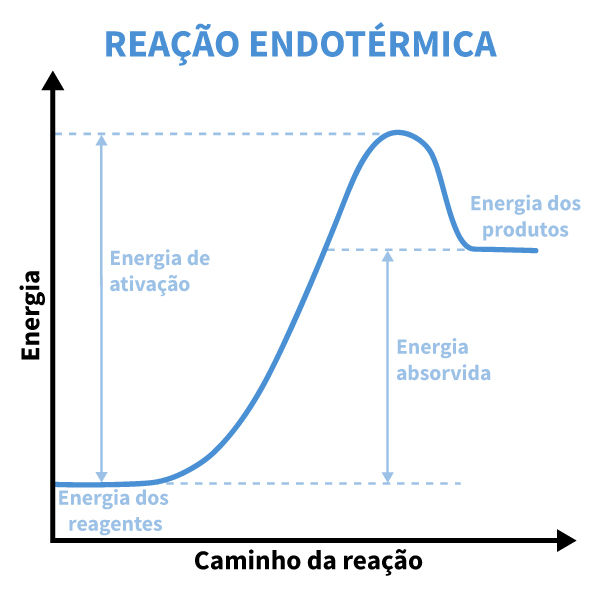
No início do gráfico, a energia dos reagentes é relativamente baixa, mas, à medida que a reação prossegue, o sistema precisa absorver uma quantidade adicional de energia. Essa absorção de energia é ilustrada por uma curva ascendente.
Esse aumento no gráfico de energia indica que a variação de entalpia (ΔH) é positiva, ou seja, ΔH > 0. A variação positiva se deve ao fato de que a energia dos produtos é maior que a energia dos reagentes, indicando que houve um ganho energético no sistema. Essa diferença de energia ganha é fornecida pelo ambiente.
→ Gráfico de reação exotérmica: variação de entalpia negativa (ΔH < 0)
As reações exotérmicas, em contraste, liberam energia para o ambiente, diminuindo a energia interna do sistema, como mostra o gráfico a seguir.
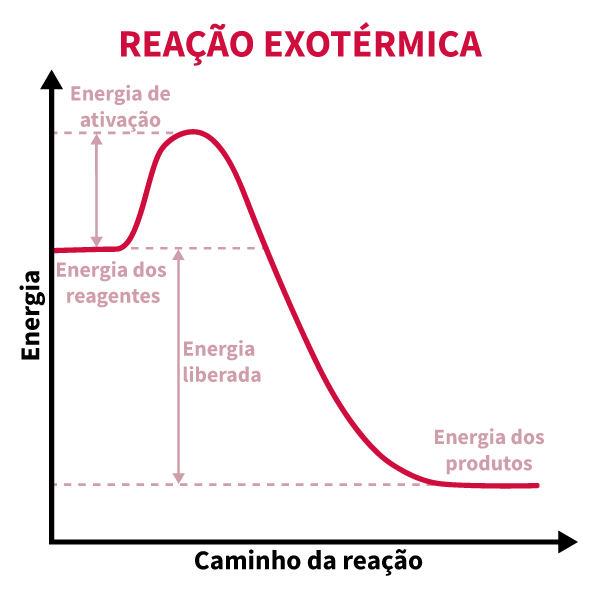
No gráfico de energia de uma reação exotérmica, vemos que o nível de energia dos reagentes é mais alto que o dos produtos. Nesse tipo de reação, a energia armazenada nas ligações químicas dos reagentes é liberada ao ambiente, e o gráfico apresenta uma curva descendente.
Essa curva descendente indica que a variação de entalpia (ΔH) é negativa, ou seja, ΔH < 0. A variação negativa ocorre porque a energia dos produtos formados é menor do que a energia dos reagentes, resultando na liberação da diferença de energia para o ambiente.
→ Representação em equações termoquímicas
Além dos gráficos de energia, as reações endotérmicas e exotérmicas podem ser representadas por meio de equações termoquímicas, que indicam não apenas os reagentes e produtos envolvidos como também a energia associada ao processo. A energia em uma equação termoquímica é descrita na forma de entalpia (ΔH).
Além da energia, a equação termoquímica deve apresentar a temperatura e a pressão em que o processo ocorreu. Quando a temperatura e a pressão não são descritas, subtende-se que o processo foi realizado nas condições padrão de temperatura e pressão (25 °C e 1 bar).
A representação de uma equação termoquímica é feita com a variação de entalpia ao lado dos produtos, como pode-se ver abaixo, na equação termoquímica que descreve a energia liberada na reação entre 1 mol de gás hidrogênio e 1 mol de gás cloro para formar 2 mol de ácido clorídrico:
\(H_{2(g)} + Cl_{2(g)} \rightarrow 2HCl_{2(g)} \ \ \ \ \ \ \Delta H = -185 KJ/mol\)
Contudo, também é comum a demonstração do valor de entalpia dentro de uma equação química, que pode aparecer no lado dos reagentes ou no lado dos produtos. Apesar de comum, essa não é a forma mais correta de representação, pois gera uma ambiguidade.
Veja abaixo as variações na representação da equação termoquímica anterior e como a energia pode ser representada em um processo exotérmico:
- Energia no lado dos reagentes: H2(g) + Cl2(g) − 185 kJ → 2 HCl(g)
- Energia no lado dos produtos: H2(g) + Cl2(g) → 2 HCl(g) + 185 kJ
Nesse caso, é necessário certo cuidado para não interpretar errado o sinal da entalpia. Na equação 1, a energia aparece no lado dos reagentes. Perceba que ela apresenta o valor negativo que caracteriza o processo exotérmico. Isso ocorre porque, em uma transformação exotérmica, ocorre uma diminuição da energia do sistema. Contrariamente, no lado dos produtos (equação 2), o valor da entalpia é positivo, e isso ocorre porque a energia perdida pelo sistema é adicionada ao ambiente.
A mesma interpretação pode ser feita para as transformações endotérmicas, que podem ser representadas por meio de equações das seguintes formas:
- ZnCO3(s) → ZnO(s) + CO2(g) ΔH = + 71,5 KJ/mol
- ZnCO3(s) + 71,5 KJ → ZnO(s) + CO2(g)
- ZnCO3(s) → ZnO(s) + CO2(g) − 71,5 KJ
A variação da entalpia é positiva em uma reação endotérmica, como mostra a equação termoquímica 1. Perceba que, na equação 2, o valor da entalpia permanece positivo no lado dos reagentes, indicando que ocorre uma absorção de energia do ambiente, ou seja, energia é adicionada ao sistema. Por outro lado, na equação 3, a energia é representada no lado dos produtos e com sinal negativo, indicando que o ambiente perde energia para o sistema.
Cálculo de reações endotérmicas e exotérmicas
O cálculo de reações endotérmicas e exotérmicas envolve a determinação da variação de entalpia (ΔH), que representa a diferença de energia entre os reagentes e produtos em uma reação química. A variação de entalpia permite identificar se uma reação absorve energia (endotérmica) ou libera energia (exotérmica). Existem diferentes métodos para calcular essa variação de entalpia, entre os quais se destacam a Lei de Hess, a entalpia de formação e a energia de ligação.
→ Cálculo do ΔH pela Lei de Hess
A Lei de Hess afirma que a variação de entalpia de uma reação química depende apenas do estado inicial e final do sistema, independentemente do caminho ou das etapas intermediárias que ocorrem durante a reação. Essa lei é fundamental para o cálculo da variação de entalpia em reações que não podem ser medidas diretamente, utilizando valores de entalpias conhecidas de reações intermediárias.
Para entender como é realizado o cálculo do ΔH pela Lei de Hess, vamos utilizar a seguinte reação:
\(C_{(grafite)} + 2H_{2(g)} \rightarrow CH_{4(g)} \ \ \ \ \Delta H =?\)
É importante conhecer o ΔH de outras reações para utilizá-lo como auxiliar no cálculo. Assim vamos utilizar as seguintes reações:
Equação 1: \(C_{(grafite)} + O_{2(g)} \rightarrow CO_{2(g)} \ \ \ \ \Delta H_1 = - 394,0\ kJ/mol\)
Equação 2: \(H_{2(g)} + \frac{1}{2}O_{2(g)} \rightarrow H_{2}O_{(l)} \ \ \ \ \Delta H_2 = -286,0\ kJ/mol\)
Equação 3: \(CH_{4(g)} + 2O_{2(g)} \rightarrow CO_{2(g)} + 2H_2O_{(l)} \ \ \ \ \Delta H_3 = -890,0\ kJ/mol\)
O cálculo pela Lei de Hess seguirá as seguintes etapas:
- Etapa 1: Análise das equações
A equação que queremos encontrar (reação alvo) envolve a formação do metano (CH₄) a partir de carbono (grafite) e hidrogênio gasoso.
As equações dadas envolvem a combustão de carbono, hidrogênio e metano, formando dióxido de carbono e água.
- Etapa 2: Manipulação das equações
O objetivo é combinar as equações dadas de forma a obter-se a equação-alvo. Dessa forma, realizaremos os seguintes procedimentos:
Equação 1: Inalterada.
Equação 2: Precisamos multiplicar essa equação por 2 para que tenhamos 2 mols de H₂O, como na equação-alvo.
\(2H_{2(g)} + O_{2(g)} \rightarrow 2H_{2}O_{(l)} \ \ \ \ \Delta H_2 = -572,0\ kJ/mol\)
Perceba que, ao multiplicar a reação por 2, o valor de ΔH também é multiplicado por 2.
Equação 3: Precisamos inverter essa equação para que o metano apareça como produto, assim como na equação-alvo.
\(CO_{2(g)} + 2H_2O_{(l)} \rightarrow CH_{4(g)} + 2O_{2(g)} \ \ \ \ \Delta H_3 = +890,0\ kJ/mol\)
- Etapa 3: Soma das equações manipuladas
Somando as equações, é realizado o cancelamento das substâncias iguais que aparecem na mesma quantidade no lado dos reagentes de uma reação e nos produtos de outra reação.
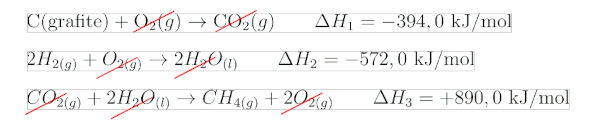
A equação final, obtida após os cancelamentos de CO₂, H₂O e O₂, é:
\(C_{(grafite)} + 2H_{2(g)} \rightarrow CH_{4(g)} \ \ \ \ \Delta H =-76,0\ kJ/mol\)
O valor do ΔH é obtido pela soma dos valores da variação de entalpia:
ΔH = ΔH1 + ΔH2' + ΔH3' = -394,0 kJ/mol + (-572,0 kJ/mol) + 890,0 kJ/mol = -76,0 kJ/mol.
Assim, temos que o ΔH para a formação do metano a partir de grafite e hidrogênio gasoso é de -76,0 kJ/mol. Isso significa que a reação é exotérmica, liberando 76,0 kJ de energia por mol de metano formado.
→ Cálculo do ΔH pela entalpia de formação
A entalpia de formação é a variação de entalpia associada à formação de 1 mol de um composto formado por elementos em seus estados padrão. Para calcular o ΔH de uma reação por meio da entalpia de formação, utilizamos a diferença entre a soma das entalpias de formação dos produtos e a soma das entalpias de formação dos reagentes.
A expressão geral é:
\(\Delta H = \sum(\Delta H_f\ produtos) - \sum(\Delta H_f\ reagentes)\)
Para calcular o ΔH pela entalpia de formação, vamos considerar a reação de combustão do metano (CH₄) para formar dióxido de carbono (CO₂) e água (H₂O):
\(CH_{4(g)} + 2O_{2(g)} \rightarrow CO_{2(g)} + 2H_2O_{(l)}\)
Os valores de entalpia de formação são:
- ΔHf (CH₄) = -74,8 kJ/mol
- ΔHf (O₂) = 0 kJ/mol (elemento em estado padrão)
- ΔHf (CO₂) = -393,5 kJ/mol
- ΔHf (H₂O) = -285,8 kJ/mol
Agora, aplicamos esses valores na fórmula:
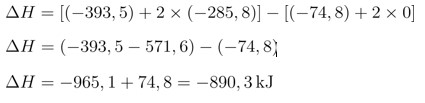
Assim, a variação de entalpia da combustão do metano é ΔH = -890,3 kJ, indicando uma reação exotérmica.
→ Cálculo do ΔH pela energia de ligação
A energia de ligação é a energia necessária para quebrar uma ligação entre dois átomos em uma molécula no estado gasoso. No cálculo da variação de entalpia usando energias de ligação, consideramos a energia necessária para quebrar todas as ligações dos reagentes e a energia liberada na formação das ligações dos produtos. Esse método é útil principalmente para reações gasosas.
Para entender como é realizado esse cálculo, vamos calcular o ΔH para a reação de formação de água (H₂O) por meio do hidrogênio (H₂) e oxigênio (O₂):
\(H_{2(g)} + \frac{1}{2}O_{2(g)} \rightarrow H_{2}O_{(g)}\)
As energias de ligação são:
- Ligação H–H (H₂) = 436,0 kJ/mol
- Ligação O=O (O₂) = 496 kJ/mol
- Ligação O–H (H₂O) = 463 kJ/mol
Os valores das energias são sempre positivos, pois se referem à quebra de ligações, um processo endotérmico; porém a formação de uma nova ligação química é um processo exotérmico e, por isso, o valor deve ser considerado com sinal negativo.
Para calcular ΔH, primeiro determinamos a energia total para quebrar as ligações dos reagentes e, em seguida, para formar as ligações dos produtos. Assim, teremos:
- Energia necessária para quebrar as ligações dos reagentes:
- Quebra de 1 mol de H-H, no H2: 436,0 kJ
- Quebra de 0,5 mol de O=O, no O2: 0,5. 496 kJ = 248 kJ
Total para os reagentes = 436 + 249 = 685 kJ
- Energia liberada na formação das ligações dos produtos:
- Formação de 2 mols de O–H, no H2O: 2. (– 463) = – 926 kJ
A variação de entalpia da reação será dada pela soma das energias absorvidas (ligações nos reagentes) com a energia liberada (ligações nos produtos), como mostrado abaixo:
ΔH = 436 + 248 – 926 kJ = – 242 kJ/mol
Isso significa que a formação de uma molécula de água por meio de hidrogênio e oxigênio libera 242 kJ de energia.
O que é entalpia?
Entalpia é uma grandeza termodinâmica que representa a quantidade total de energia de um sistema em função de sua pressão e volume. Ela é especialmente útil em reações químicas, pois permite avaliar o fluxo de energia entre o sistema e o ambiente em processos realizados sob pressão constante. A entalpia é geralmente denotada pela letra H, e suas variações refletem as trocas de energia durante uma reação ou transformação química.

Quando ocorre uma reação química, há uma variação de entalpia (ΔH), que corresponde à diferença entre a entalpia dos produtos e a entalpia dos reagentes. Essa variação de energia é expressa em joules (J) ou quilojoules (kJ) e pode ser positiva (nos processos endotérmicos) ou negativa (nos processos exotérmicos).
A entalpia de uma reação pode ser alterada por alguns fatores principais:
- Quantidade de reagentes e produtos: quanto maior a quantidade de substâncias envolvidas, maior será o valor da variação de entalpia. Por exemplo, se duplicarmos a quantidade de reagentes de uma reação, o valor de ΔH também será duplicado, como no caso da combustão do metano abaixo:
\(CH_{4(g)} + 2O_{2(g)} \rightarrow CO_{2(g)} + 2H_2O_{(g)} \ \ \ \Delta H = -890\ kJ\)
Se dobrarmos a quantidade de metano, a variação de entalpia se torna -1780 kJ.
- Temperatura: a variação de entalpia pode ser influenciada pela temperatura, pois o calor envolvido em uma reação depende do estado energético dos reagentes e produtos, que varia conforme a temperatura.
- Fases de agregação das substâncias (estados físicos): a entalpia de uma substância varia conforme seu estado físico (sólido, líquido ou gasoso). Por exemplo, a entalpia de formação da água é diferente no estado líquido e no estado gasoso, como pode ser visto a seguir:
\(H_{2(g)} + \frac{1}{2}O_{2(g)} \rightarrow H_{2}O_{(l)} \ \ \ \Delta H = -286\ kJ/mol\)
\(H_{2(g)} + \frac{1}{2}O_{2(g)} \rightarrow H_{2}O_{(g)} \ \ \ \Delta H = -242\ kJ/mol\)
- Alotropia: substâncias que têm diferentes formas alotrópicas (como o carbono, que existe como grafite e diamante) também apresentam variações na entalpia de formação para cada uma de suas formas alotrópicas.
A entalpia pode ser classificada quanto ao tipo de processo. Assim, os tipos de entalpia são: formação, combustão, ligação, neutralização e dissolução. Entre elas, vale destacar as entalpias de formação e combustão, comumente utilizadas para entender a energia envolvida na formação de substâncias e calcular o poder calorífico de um composto.
→ Tipos de entalpia
-
Entalpia de formação (ΔHf)
A entalpia de formação (ΔHf) é a variação de entalpia associada à formação de 1 mol de uma substância com base em seus elementos em suas formas mais estáveis, sob condições padrão de temperatura e pressão (298 K e 1 atm). A entalpia de formação é essencial para determinar a energia envolvida na síntese de compostos a partir de seus elementos básicos.
Exemplo: A formação do dióxido de carbono com base em carbono e oxigênio:
\(C_{(s)} + O_{2(g)} \rightarrow CO_{2(g)} \ \ \ \ \Delta H_f = - 393,5\ kJ/mol\)
Esse valor indica que, para formar 1 mol de dióxido de carbono a partir de grafite e oxigênio gasoso, 393,5 kJ de energia são liberados.
-
Entalpia de combustão (ΔHc)
A entalpia de combustão (ΔHc) é a variação de entalpia na reação de combustão completa de 1 mol de uma substância na presença de oxigênio. Em geral, a combustão é uma reação exotérmica (libera energia), e a entalpia de combustão é frequentemente usada para calcular o poder calorífico de combustíveis.
Exemplo: A combustão do metano no oxigênio:
\(CH_{4(g)} + 2O_{2(g)} \rightarrow CO_{2(g)} + 2H_2O_{(g)} \ \ \ \Delta H_c = -890\ kJ/mol\)
Nesse caso, a combustão completa de 1 mol de metano libera 890 kJ de energia.
Reações endotérmicas e exotérmicas no dia a dia
No dia a dia, podemos perceber reações endotérmicas e exotérmicas por meio da sensação de frio ou quente que elas causam. Quando uma reação química absorve energia do ambiente, sentimos um resfriamento local, característico de um processo endotérmico. Por outro lado, quando a reação libera energia, geralmente sentimos um aquecimento local, típico de uma reação exotérmica.
Essa diferença é útil para identificar certos tipos de reações na prática cotidiana, além de nos ajudar a compreender a dinâmica das trocas de energia ao nosso redor. Seguem alguns exemplos:
- Bolsa de gelo instantânea (endotérmico): Um exemplo clássico de reação endotérmica é o funcionamento das bolsas de gelo instantâneas usadas para contusões. Ao romper um compartimento dentro da bolsa, substâncias como nitrato de amônio se dissolvem em água e absorvem calor do ambiente, causando uma queda de temperatura instantânea. Esse processo é especialmente interessante porque a sensação de frio ocorre pela absorção de calor do local, ajudando a reduzir a dor e o inchaço na região afetada.
- Queima de combustível (exotérmico): A queima de combustíveis, como a gasolina e o gás de cozinha, é um exemplo comum de reação exotérmica. Durante a combustão, substâncias como o metano reagem com o oxigênio e liberam uma grande quantidade de energia na forma de calor e luz, aquecendo o ambiente. Essa energia é essencial para muitos processos no cotidiano, como aquecer água, cozinhar alimentos e movimentar veículos.
- Reação de oxidação do ferro – ferrugem (exotérmico): A formação de ferrugem pode não parecer uma reação exotérmica, mas, durante o processo de oxidação, ocorre uma liberação lenta de calor. Embora a energia liberada pela formação de óxidos de ferro não seja perceptível ao toque, a reação exotérmica presente (e em larga escala, como em estruturas metálicas expostas) pode ser medida.
Além de reações químicas evidentes, há fenômenos naturais que envolvem absorção ou liberação de energia, e muitos deles podem ser menos óbvios:
- Evaporação da água (endotérmico): Quando a água evapora, ela absorve energia do ambiente. Esse processo é o que ocorre, por exemplo, quando saímos da piscina e sentimos frio, pois a água em nossa pele absorve calor para evaporar, causando a sensação de resfriamento. Esse fenômeno endotérmico é fundamental em processos naturais, como a transpiração das plantas, que regula a temperatura das folhas.
- Condensação do vapor d’água (exotérmico): A transformação do vapor d’água em líquido também é uma reação exotérmica, pois ocorre com a liberação de calor para o ambiente. Esse fenômeno explica, por exemplo, a formação de gotículas de água nas superfícies de objetos frios em dias quentes. A condensação é um processo importante para o ciclo da água e para a formação de nuvens e chuva.
Esses exemplos ilustram como reações e fenômenos endotérmicos e exotérmicos estão integrados ao nosso cotidiano e contribuem para o equilíbrio térmico e energético do ambiente.
Saiba mais: Vaporização e condensação — dois processos inversos
Exercícios resolvidos sobre reações endotérmicas e exotérmicas
Questão 1 (Enem) Um incêndio atingiu uma fábrica de resíduos industriais em Itapevi, na Grande São Paulo. O local armazenava três toneladas de fosfeto de alumínio. De acordo com a Companhia Ambiental do Estado de São Paulo (Cetesb), o fosfeto de alumínio reagiu com a água usada para apagar as chamas, produzindo hidróxido de alumínio e fosfina.
A fosfina é um gás tóxico, incolor, e não reage com a água, porém reage rapidamente com o oxigênio liberando calor e produzindo pentóxido de difosfóro. Segundo os médicos, a inalação do pode causar queimadura tanto na pele quanto nas vias respiratórias devido à formação de ácido fosfórico
Os gráficos 1, 2 e 3 representam a variação da energia em função do caminho da reação para três transformações químicas, sendo o reagente e o produto de cada reação.
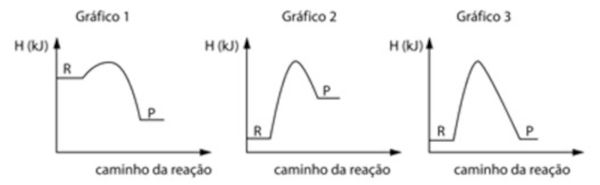
Entre os gráficos 1, 2 e 3, aquele que representa corretamente a reação da fosfina com o oxigênio, descrita no texto, é o
a) gráfico 1, pois a reação é endotérmica e apresenta ΔrH° < 0.
b) gráfico 1, pois a reação é exotérmica e apresenta ΔrH0° < 0.
c) gráfico 2, pois a reação é endotérmica e apresenta ΔrH° > 0.
d) gráfico 2, pois a reação é exotérmica e apresenta ΔrH0° < 0.
e) gráfico 3, pois a reação é endotérmica e apresenta ΔrH° > 0.
Resposta: letra b)
Resolução: O texto descreve que a reação da fosfina com o oxigênio libera calor, ou seja, é exotérmica. Além disso, a reação é rápida e espontânea, o que indica que a energia dos produtos é menor que a dos reagentes.
Analisando os gráficos:
- Gráfico 1: Apresenta uma reação exotérmica (libera calor), o que condiz com a reação da fosfina.
- Gráfico 2: Apresenta uma reação endotérmica (absorve calor) e a energia dos produtos é maior que a dos reagentes, o que não condiz com a reação descrita no texto.
- Gráfico 3: Apresenta uma reação onde os reagentes e produtos apresentam a mesma energia.
Conclusão:
O gráfico que melhor representa a reação da fosfina com o oxigênio é o gráfico 1.
Justificativa:
A resposta correta é a alternativa b): gráfico 1, pois a reação é exotérmica e apresenta ΔrH° < 0.
ΔrH° < 0 indica que a entalpia dos produtos é menor que a dos reagentes, o que é característico de uma reação exotérmica.
Questão 2 (Enem) Atualmente, soldados em campo, seja em treinamento ou em combate, podem aquecer suas refeições, prontas e embaladas em bolsas plásticas, utilizando aquecedores químicos, sem precisar fazer fogo. Dentro dessas bolsas existe magnésio metálico em pó e, quando o soldado quer aquecer a comida, ele coloca água dentro da bolsa, promovendo a reação descrita pela equação química:
Mg(s) + 2 H2O → Mg(OH)2(s) + H2 + 350kJ
O aquecimento dentro da bolsa ocorre por causa da:
a) redução sofrida pelo oxigênio, que é uma reação exotérmica.
b) oxidação sofrida pelo magnésio, que é uma reação exotérmica.
c) redução sofrida pelo magnésio, que é uma reação endotérmica.
d) oxidação sofrida pelo hidrogênio, que é uma reação exotérmica.
e) redução sofrida pelo hidrogênio, que é uma reação endotérmica.
Resposta: letra b)
Resolução: O magnésio metálico (Mg) apresenta nox = 0, pois é substância simples. Quando reage com a água e forma a base Mg(OH)2, sofre uma oxidação, passando a ter nox = +2.
Na equação, o valor de entalpia é apresentado no lado dos produtos, com sinal positivo, o que indica que essa energia é adicionada ao ambiente, ou seja, a reação ocorre com liberação de calor (350 kJ), caracterizando uma transformação exotérmica.
Logo, a alternativa correta é a b): Oxidação sofrida pelo magnésio, que é uma reação exotérmica.
Fontes
ATKINS, P. W. PAULA, J. de. Fundamentos de Físico-Química. Vol 1. 5 ed. Rio de Janeiro: LTC, 2003.
ATKINS, Peter; JONES, Loretta; Princípios de química: questionando a vida moderna e o meio ambiente; 3ª ed.;Porto Alegre; Bookman; 2006.
CHANG, Raymond; Química Geral: Conceitos Essenciais; 4ªed.; São Paulo;McGraw-Hill;2007.




.jpg)